
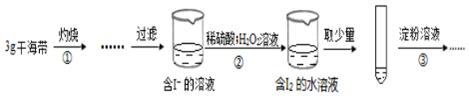
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
分析 由流程可知,海带在坩埚中灼烧后,溶解、过滤得到含碘离子的溶液,加氧化剂氧化,生成碘的水溶液,加淀粉变蓝可检验碘单质,再萃取、分液、蒸馏可得到碘,以此来解答.
解答 解:A.步骤①为灼烧,需要将干海带放入坩埚中灼烧,故A正确;
B.步骤②发生氧化还原反应,离子方程式为2I-+2H++H2O2=I2+2H2O,遵循电子、电荷守恒,故B正确;
C.步骤③操作后,观察到试管中溶液变为蓝色,可知②中有碘生成,可以说明海带中含有碘元素,故C正确;
D.若步骤②仅滴加稀硫酸后放置一会儿,可发生4I-+4H++O2=2I2+2H2O,步骤③操作后,试管中溶液变为蓝色,故D错误;
故选D.
点评 本题考查海水提取碘的实验,为高频考点,把握流程中发生的反应、混合物分离提纯、物质的检验为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
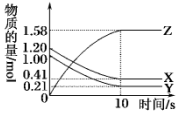 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用X表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s,Y的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应10s时达到化学平衡状态,Z的平衡浓度为0.79 mol•L-1 | |
| D. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前后气体的压强之比为4:3 | |
| B. | 反应前后气体的密度之比为l5:16 | |
| C. | H2与CO的转化率相等,均为50% | |
| D. | 若H2与CO按8:5体积比混合,则反应前后混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
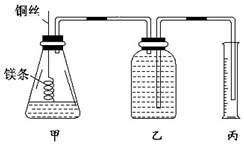 某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④⑤ | C. | ①④⑥ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl═H++Cl- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com