
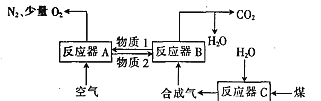
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
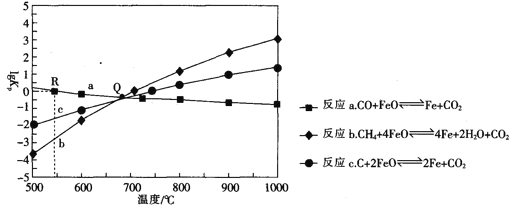
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
【答案】C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1 不能 经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸 bc 50% P02 正反应 增大
【解析】
Ⅰ(1)应用盖斯定律进行计算。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小;反应b、c,升高温度,lgKp增大,Kp增大,再分析每一个反应平衡移动得出结论。
(4)建立“三步走”,再计算压强平衡常数,最后得出结论。
Ⅲ(5)先建立“三步走”,计算消耗的量,再根据压强平衡常数进行计算。
(6)利用压强之比等于物质的量之比,得出此时压强,再根据计算此时的压强常数,与平衡压强常数比较,再得出结论。
(7)利用相当于改变压强的情况来分析平衡怎样移动,得出平衡转化率变化。
Ⅰ(1)应用盖斯定律,第一个方程式加上第二个方程式,得到总反应的热化学方程式:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1,故答案为:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸,因此不能直接用作工业合成氨的原料气,原因是经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸,故答案为:不能;经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小,平衡逆向移动,逆向是吸热反应,正向为放热反应,反应b、c,升高温度,lgKp增大,Kp增大,平衡正向移动,正向是吸热反应,即属于吸热反应的是反应b、c,故答案为:b、c。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,lgKp=0,Kp=1。


解得x = 0.5mol
![]() ,则CO的平衡转化率为50%,故答案为:50%。
,则CO的平衡转化率为50%,故答案为:50%。
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。

根据压强之比等于物质的量之比,P0:2P0=1mol:(1-x+2x+x)mol,解得x=0.5mol,
(5)T℃下,该反应的 ,故Kp = P02,故答案为:P02。
,故Kp = P02,故答案为:P02。
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时物质的量是原来的2.5倍,因此压强是原来的2.5倍,此时 ,因此反应向正反应方向进行,故答案为:正反应。
,因此反应向正反应方向进行,故答案为:正反应。
(7)将该容器改为恒压密闭容器,容器体积变大,相当于在原来容器基础上减小压强,平衡正向移动,CH4的平衡转化率增大,故答案为:增大。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.①、②、③的反应类型分别为卤代、水解、消去
C.A能使高锰酸钾酸性溶液褪色
D.A的结构简式是CH2=CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如图1:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)

(1)把NaCl和AlCl3的固体混合物置于如图2所示的装置的一端,加热到___(最低温度)℃,即可分离NaCl和AlCl3
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有___;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是___。
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:①H++OH-=H2O,②___
(4)镀铝电镀池中,金属铝为阳极,熔融盐电镀池中存在Na+K+______等离子钢材表面(电极)的电极反应式为AlCl4-+3e-=Al+4Cl-或___
(5)钢材镀铝后,在表面氧化成致密的___,避免钢材接触空气而防止钢材被腐蚀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、![]() 、Fe3+、
、Fe3+、![]() 、
、![]() 、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
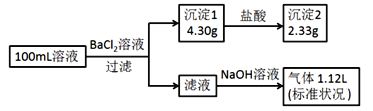
A.原溶液一定存在 ![]() 和
和![]() ,一定不存在 Fe3+
,一定不存在 Fe3+
B.原溶液可能存在 Cl- 和 Na+
C.原溶液中 c(![]() )是 0.01molL-1
)是 0.01molL-1
D.若原溶液中不存在 Na+,则 c(Cl-)<0.1molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大型化工厂产生的酸性废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。

(1)操作①的名称是________________, 沉淀A中含有的金属单质有________________。
(2)溶液A中加入H2O2溶液过程中发生反应的离子反应式________________________________,操作②为持续加热保温,在此过程中温度不宜过高的原因是________________________________。
(3)检验溶液B中含有的金属阳离子的实验方法为:取少量溶液B于洁净的小试管中,加入______试剂,溶液迅速转变为________色,即可检验。
(4)操作③中发生反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
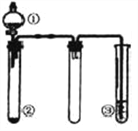
选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。

(1)关闭装置Ⅰ中的止水夹,向分液漏斗中加适量水,打开活塞,说明Ⅰ气密性良好的现象是______________________。
(2)利用装置Ⅰ制取氨气,不能选用的试剂为浓氨水和________(填字母)。
A.氢氧化钠 B.碱石灰 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接________、________接________、______接______。______
(4)收集氨气,按如图装置进行NH3性质的探究实验。
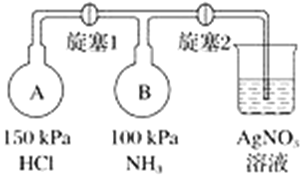
①打开旋塞1,B瓶中的现象是_________________________________________,原因是_____________________________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com