
����Ŀ��H2��CO��CH4��CH3OH�ȶ�����Ҫ����Դ��Ҳ����ҪΪ����ԭ�ϡ�
��1����֪25�棬1.01��105Paʱ��,8.0DgCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������дɽ�÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��____________________��
��2��Ϊ���������ܼ�����������̼�����������ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����ҵ�Ͽ�����CO2������ȼ�ϼ״���
�����Ϊ2L���ܱ������У�����lmolCO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
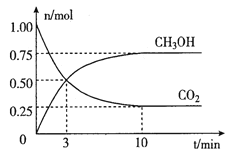
�ٴӷ���ʼ��ƽ����CO2��ƽ����Ӧ����v(CO2)=____��
�ڴﵽƽ��ʱ��H2��ת����Ϊ__________��
�����д�ʩ������߷�Ӧ���ʵ���__________��
A.�����¶� B.������� C.����ѹǿ D.��ʱ�����CH3OH
��3����ҵ��Ҳ��CO��H2Ϊԭ���Ʊ�CH3OH����Ӧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
A.��Ӧ��CO��CH3OH�����ʵ���֮��Ϊ1:1
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����1molCO��ͬʱ����1mclCH3OH
D.CH3OH�����������ڻ�������б��ֲ���
E.���������ܶȱ��ֲ���
���𰸡� CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol 0.0375mol/(L��min) 75% D BD
��������(1)0.5mol������ȫȼ�շ���444.8kJ��1mol������ȫȼ�շ���889.6kJ���ݴ�д��������ȫȼ�յ��Ȼ�ѧ��ʽ��
��2����������ʽ���ⷨ������ؼ��㣬�����Ӧ�б仯����ƽ����������v=c/t����������������ƽ��Ũ���ж�ת�������ʵ���,�����ɼ���ת������
��3������Ӧ�ﵽƽ��״̬ʱ,�����淴Ӧ�������(ͬ������),�����ʵ�Ũ�ȡ��������ٸı�,�Լ��ɴ�������һЩ������Ҳ�������Դ˽����ж���
��1��8.0gCH4����Ϊ0.5mol����ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������1molCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�889.6kJ�������Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol����ȷ����CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol��
��2����������ʽ���ⷨ����:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ�� 1 3 0 0
�仯�� 0.75 2.25 0.75 0.75
ƽ���� 0.25 0.75 0.75 0.75
�ٷ�Ӧ��ƽ����CO2��ƽ����Ӧ����v(CO2)=0.75/2��10= 0.0375mol/(L��min)����ȷ����0.0375mol/(L��min)��
�ڴﵽƽ��ʱ��H2��ת����Ϊ2.25/3��100%=75%����ȷ����75%��
��A.�����¶�����Ӧ���ʼӿ���������B.�������������̶ȵؼӿ췴Ӧ������������C.����ѹǿ����С�������������Ũ������Ӧ���ʼӿ���������D.��ʱ�����CH3OH����С������Ũ������Ӧ���ʼ�������ȷ����ȷѡ��D��
��3��A.ƽ��ʱ��Ӧ��������ֵ����ʵ�������,������ֵ����ʵ�����һ�����,A������B.��Ϊ�÷�ӦΪ����������С�ķ�Ӧ���淴Ӧ���л�����������ʵ��������仯,��������ѹǿ����ʱ��ı仯���仯,˵����������ܵ����ʵ����ٲ���,˵����Ӧ����ƽ��,B��ȷ��C.��λʱ��������1molCO,ͬʱ����1molCH3OH,����ʾ����Ӧ����,��Ӧʼ�հ��˹�ϵ����,����˵������ƽ��, C������D.CH3OH�����������ڻ�������б��ֲ�����˵�����淴Ӧ�������������ƽ��״̬, D��ȷ��E.��Ӧǰ������������������������������������������ܶ�ʼ��Ϊ��ֵ�������ж���Ӧ�ﵽƽ��״̬��E��������ȷѡ��BD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ������ ��
A. ���Ȼ�����Һ�м��������ˮ��Al3++4NH3��H2O=4AlO2-+4NH4++2H2O
B. ����������ϡ���ᷴӦ��������S2-+2H+=H2S��
C. ˫��ˮ�м���ϡ�����KI��Һ��H2O2+2H++2I-=I2+2H2O
D. ��NH4HCO3��Һ�мӹ�����NaOH��Һ��������NH4++OH-![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼�ǵ���������������������Ԫ��֮һ������Ҫ��ش��������⣺
(1)̼ԭ�ӵļ۵����Ų�ʽ______________��������_________�ֲ�ͬ�˶�״̬�ĵ��ӡ�
(2)̼�����γɶ����л��������ͼ��ʾ��һ�����ʺ�һ����वĽṹ�����ַ���������ԭ�Ӷ���һ��ƽ���ϡ�
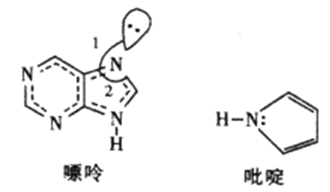
������������Ԫ�صĵ縺���ɴ�С��˳��__________________��
�������й��֮��ļнǡ�1�ȡ�2����ԭ��__________________��
����ऽṹ��Nԭ�ӵ��ӻ���ʽ__________________��
�ܷ����еĴ�м����÷��Ŧ�![]() ��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
(3)̼Ԫ�����γ�CO��CO2��H2CO3�ȶ����������
�ٶ�����̼�ľ�������ɱ���ÿ��������̼������Χͨ����__________�����ڵķ��ӡ�
����COת����CO2�ķ�Ӧ�����У�����˵����ȷ����__________��
A.�����йµ��Ӷ������� B.���ӵļ��Է����仯
C.ԭ�Ӽ�ɼ���ʽ�����ı� D.���Ӿ�����۷е�����
��H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��_________��
(4)2017�꣬�����ѧ���Ŷӹ�ͬ�ϳ���̼��һ������ͬ�������壺T-̼��T-̼�Ľṹ�ǽ��������ʯ�е�ÿ��̼ԭ����һ����4��̼ԭ����ɵ���������ṹ��Ԫȡ���γ�̼��һ��������ά��������ṹ������ͼ����֪T̼��������Ϊa pm������٤������ΪNA����T̼���ܶȵı���ʽΪ__________g/cm3��(д������ʽ����)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2����Ҫ������Ⱦ��֮һ����ҵ�Ͽ�������װ������ת��SO2(A��BΪ���Ե缫)������˵����ȷ����

A. ��������������B��b��a��A
B. a��A���Ͼ�����������Ӧ
C. ���ӽ���ĤΪ�����ӽ���Ĥ
D. B���ϵĵ缫��ӦʽΪ��SO2+2e��+2H2O=SO42-+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017���ҹ��н�ȫ��������ɿ���2500�����ҵ��������δ��������Դ�Ŀ���������Ҫս�Լ�ֵ��������зḻ���̽�˿�(��Ҫ�ɷ�ΪMnO2��������Fe��Al������Ԫ��)�������̽�˿�����Ʊ��ߴ�̼���̣���ش������й�����:
��1��д����MnO2��Ũ������ȡ�����Ļ�ѧ����ʽ________________��
��2��MnO2���������ķ�Ӧʮ�ָ��ӡ������������£�MnO2���Ա�H2O2��ԭ��Mn2+����H2O2���������ԣ����о�������H2O2��Һ����������HO2-���¡�����������ͬʱ���о���ͬ��ʼpH������H2O2��Һ��Ư��Ч���������ͼ��ʾ:
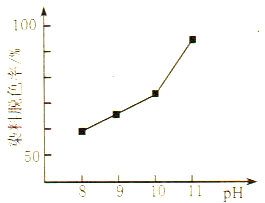
��д��MnO2��������������H2O2��Ӧ�����ӷ���ʽ____________��
����ͼ�ɵõ��Ľ�����_________�����ƽ���ƶ�ԭ����������:__________��
��3�������̽�˿���ʵ�����Ʊ��ߴ�̼���̵��������£�
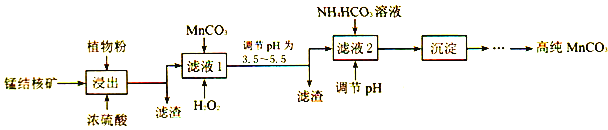
������SO2����ֲ��ۣ�ֲ��۵�������___________��
��ʹ��̼���̵�pH��������___________��
������NH4HCO3ʱ���¶�Ҫ������35�����£���Ŀ����___________��
��4���ڷ�ˮ�����г���H2S��Mn2+ת��ΪMnS��ȥ������0.020mo/LMn2+�ķ�ˮ��ͨ��һ������H2S���壬������Һ��pH����c(HS-)=1.0��10-4mol/Lʱ��Mn2+��ʼ���������ʱ��Һ��pH=______��[��֪:Ksp(MnS)=1.4��10-15��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3���壬Fe��OH��3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ���ǣ������� 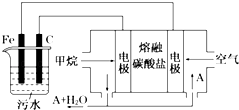
A.ʯī�缫�Ϸ���������Ӧ
B.����ͼʾ������AΪCO2
C.Ϊ��ǿ��ˮ�ĵ���������������ˮ�м��������Ҵ�
D.����ȼ�ϵ����CO32�������һ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص���ʽ����д��ȷ����( )
A. N2 �ĵ���ʽ��![]() B. NH4Cl �ĵ���ʽ��
B. NH4Cl �ĵ���ʽ��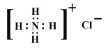
C. HClO �ĵ���ʽ��![]() D. CO2 �ĵ���ʽ��
D. CO2 �ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱵ(BaTiO3)�ڹ�ҵ������Ҫ��;����Ҫ�������������մɡ�PTC�������衢�������ȶ��ֵ���Ԫ�����������������ᱵ��һ�ֹ�������ͼ:
![]()
��֪:�ٲ��������ѱ�����Ļ�ѧʽΪBaTiO(C2O4)2��4H2O��
��25��ʱ��BaCO3���ܶȻ�Ksp=2.58��10-9��
(1)BaTiO3��TiԪ�صĻ��ϼ�Ϊ:__________��
(2)���������ʱ������Ӧ�����ӷ���ʽΪ: __________��
(3)������ͨ�����˵õ����������ѱ������Ϊ��߲�Ʒ������Ծ���ϴ�ӡ�
�ٹ��˲�����ʹ�õIJ���������_____________________��
�����֤��������ϴ��?_______________________��
(4)TiO2���кܺõ�ɢ���ԣ���һ������Ҫ��;�Ľ����������ҵ�Ͽ���TiCl4ˮ�����Ʊ����Ʊ�ʱ����������ˮ��ͬʱ���ȣ���Ŀ����:_______________��
(5)ij��ȤС��ȡ19.70gBaCO3ģ���������������Ʊ�BaTiO3���ò�Ʒ13.98g��BaTiO3�IJ���Ϊ:________��
(6)�������������������ʵ����BaCO3�ܽ�ƽ����ƶ���������Һ��c(Ba2+)=0.1mol/L����c(CO32-)�ڽ���Һ�е����Ũ��Ϊ__________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������Լ������б����ô��������Լ�ƿ����ģ� ��
��NaOH��Һ����ˮ��������Na2S��Һ ��Na2CO3��Һ����NH4Cl��Һ������ʯ��ˮ ��ŨHNO3����ŨH2SO4
A. �٢� B. �٢ڢۢܢ� C. �٢ڢۢޢߢ� D. �ݢߢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com