
| A. | 浓硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 浓硫酸 NaCl H2S |
分析 A、浓硫酸可以和氯化钠的溶液在一定条件下反应得到HCl气体,盐酸可以和硝酸银之间反应得到沉淀;
B、氢氧化钠可以和碳酸氢钙之间反应生成碳酸钙沉淀,不会出现气体;
C、NaOH溶液和(NH4)2SO4加热可以得到碱性气体氨气,氨气可以和KAl(SO4)2的水溶液反应得到氢氧化铝沉淀;
D、浓硫酸和NaCl在一定条件下反应得到HCl气体,HCl气体和硫化氢之间不反应,据据回答.
解答 解:A、浓硫酸可以和氯化钠的溶液在一定条件下反应得到HCl气体,盐酸可以和硝酸银之间反应得到白色的氯化银沉淀,符合题意,故A正确;
B、氢氧化钠可以和碳酸氢钙之间反应生成碳酸钙沉淀,但是不会出现气体,不符合题意,故B错误;
C、NaOH溶液和(NH4)2SO4加热可以得到碱性气体氨气,氨气可以和KAl(SO4)2的水溶液中的铝离子反应得到氢氧化铝白色沉淀,符合题意,故C正确;
D、浓硫酸和NaCl在一定条件下反应得到HCl气体,但是HCl气体和硫化氢之间不反应,不符合题意,故D错误;
故选AC.
点评 本题是一道物质的检验知识题目,考查物质的性质以及反应伴随的现象等知识,注意知识的灵活应用是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
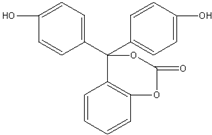 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
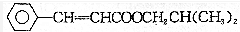 ,下列有关说法中错误的是( )
,下列有关说法中错误的是( )| A. | 在碱溶液中易变质 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为C13H16O2 | |
| D. | 与HCl恰好完全加成时可得到一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
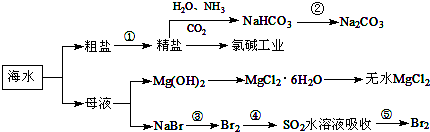
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com