
| A. | 分散质粒子的直径在1~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | Fe(OH)3胶体带正电荷,可以产生电泳现象 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
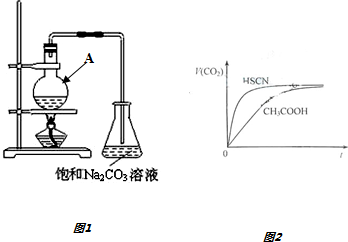
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
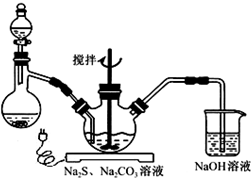 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: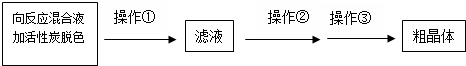
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com