
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4��g��+2O2��g��=CO2��g��+2H2O��g��������Ӧ�ҷ����ķ�ӦΪ��CH4��g��+H2O��g��![]() CO��g��+3H2��g�� ∆H1=+216kJ/mol��CH4��g��+ CO2��g��
CO��g��+3H2��g�� ∆H1=+216kJ/mol��CH4��g��+ CO2��g��![]() 2CO��g�� + 2H2��g�� ∆H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ� ��
2CO��g�� + 2H2��g�� ∆H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ� ��

A���������Ӧ�ҵ�ѹǿ�������ת���ʼ�С
B��������ά����550��750�棬Ŀ�Ľ������CH4ת��������
C������ȼ���ҵ���ҪĿ���Dz���CO2��ˮ������ԭ��������鷴Ӧ
D��������Ӧ���У��ﵽƽ��ʱ��������n(CH4)=amol��n(CO)=bmol��n(H2)=cmol,��ͨ�����Ӧ�ҵ�CH4�����ʵ���Ϊa+��b+c��/4

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
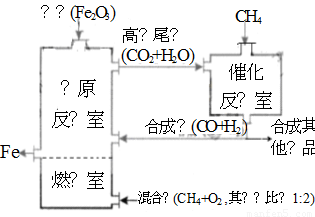
 ��2011?������ģ����¯ұ������������ͼ��ʾ��ȼ��������Ҫ��ӦΪ��
��2011?������ģ����¯ұ������������ͼ��ʾ��ȼ��������Ҫ��ӦΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
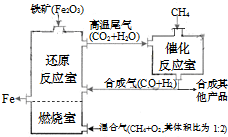 ��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4��g��+2O2��g��=CO2��g��+2H2O��g��������Ӧ�ҷ����ķ�ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+216kJ/mol��CH4��g��+CO2��g��?2CO��g��+2H2��g����H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ�������
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4��g��+2O2��g��=CO2��g��+2H2O��g��������Ӧ�ҷ����ķ�ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+216kJ/mol��CH4��g��+CO2��g��?2CO��g��+2H2��g����H2=+260kJ/mol������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4(g)+2O2(g)=CO2(g)+2H2O(g)������Ӧ�ҷ����ķ�ӦΪ��
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ??H1=+216 kJ/mol��
CO(g)+3H2(g) ??H1=+216 kJ/mol��
CH4(g)+ CO2(g)![]() 2CO(g) + 2H2(g) ??H2=+260 kJ/mol
2CO(g) + 2H2(g) ??H2=+260 kJ/mol
������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ� ��
A���������Ӧ�ҵ�ѹǿ�������ת���ʼ�С
B������Ӧ����ά����550��750�棬Ŀ�Ľ������CH4 ת��������
C������ȼ���ҵ���ҪĿ���Dz���CO2��ˮ������ԭ��������鷴Ӧ
D��������Ӧ����ƽ��ʱ��������c(CH4)=a mol��L��1, c(CO)=b mol��L��1,c(H2)=c mol��L��1
��ͨ�����Ӧ�ҵ�CH4�����ʵ���Ϊa+(b+c)/4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
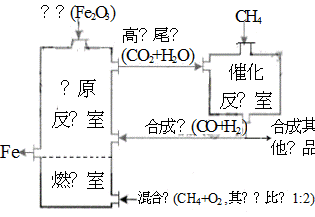
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4(g)+2O2(g)=CO2(g)+2H2O(g)������Ӧ�ҷ����ķ�ӦΪ��
CH4(g)+H2O(g)CO(g)+3H2(g) ∆H1=+216kJ/mol��
CH4(g)+CO2(g)2CO(g) + 2H2(g) ∆H2=+260kJ/mol
������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ� ��
A���������Ӧ�ҵ�ѹǿ�������ת���ʼ�С
B������Ӧ����ά����550��750�棬Ŀ�Ľ������CH4 ת��������
C������ȼ���ҵ���ҪĿ���Dz���CO2��ˮ������ԭ��������鷴Ӧ
D��������Ӧ����ƽ��ʱ��������c(CH4)=a mol��L��1, c(CO)=bmol��L��1,c(H2)=c mol��L��1
��ͨ�����Ӧ�ҵ�CH4�����ʵ���Ϊa+(b+c)/4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ��У2009-2010ѧ��ȸ�����һ����������ѧ������ ���ͣ�ѡ����
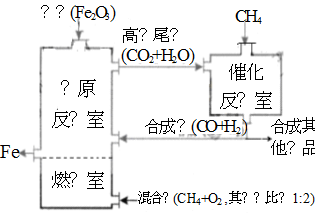
��¯ұ������������ͼ��ʹ��Ȼ�������������������������ȼ������ʹ��������Ȼ��ȼ��CH4(g)+2O2(g)=CO2(g)+2H2O(g)������Ӧ�ҷ����ķ�ӦΪ��
CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216
kJ/mol��
CO(g)+3H2(g) ∆H1=+216
kJ/mol��
CH4(g)+
CO2(g) 2CO(g) + 2H2(g) ∆H2=+260
kJ/mol
2CO(g) + 2H2(g) ∆H2=+260
kJ/mol
������������ƽ��Ĵ��ڣ�������˵����ȷ���ǣ� ��
A���������Ӧ�ҵ�ѹǿ�������ת���ʼ�С
B������Ӧ����ά����550��750�棬Ŀ�Ľ������CH4 ת��������
C������ȼ���ҵ���ҪĿ���Dz���CO2��ˮ������ԭ��������鷴Ӧ
D��������Ӧ����ƽ��ʱ��������c(CH4)=a mol��L��1, c(CO)=b mol��L��1,c(H2)=c mol��L��1
��ͨ�����Ӧ�ҵ�CH4�����ʵ���Ϊa+(b+c)/4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com