
����Ŀ����1����S2����Fe2+��Fe3+��Mg2+��S��I����H+����ֻ�������Ե���_____________��ֻ�л�ԭ�Ե���_____���������������л�ԭ�Ե���__________��
��2����ҩ���й��Ŵ����Ĵ�����֮һ���ڻ�ҩ��ըʱ�������·�Ӧ��2KNO3+C+S�TK2S+2NO2��+CO2�������б���ԭ��Ԫ����____����������Ԫ����____����������_______����ԭ����________��
��3����ƽ������ԭ��Ӧ����ʽ��_____________
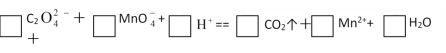
���𰸡�H+��Mg2+��Fe3+S2����I��Fe2+��SN��SCKNO3��SC5����2����16����10����2����8
��������
���̬��Ԫ��ֻ�������ԣ���ͼ�̬��Ԫ��ֻ�л�ԭ�ԣ��м��̬��Ԫ�ؼ������������л�ԭ�ԣ����ݷ�Ӧ��Ԫ�صĻ��ϼ۱仯����������Ԫ�ػ��ϼ۽��͵�����Ϊ����������Ԫ�صĻ��ϼ۽��ͣ���Ԫ���ڸ÷�Ӧ�б���ԭ���������������������������·���������ԭ��Ӧ���ɶ�����̼�������Ӻ�ˮ�����ݻ��ϼ���������ƽ��
��1��Fe3+��Mg2+��H+�еĻ��ϼ۶������̬�����Զ�ֻ�������ԣ�S2-��I-�еĻ��ϼ۶�����ͼ�̬�����Զ�ֻ�л�ԭ�ԣ�Fe2+��S�еĻ��ϼ����м��̬�����Լ������������л�ԭ�ԡ���2����Ӧ2KNO3+C+S�TK2S+2NO2��+CO2���У�N��SԪ�ػ��ϼ۽��ͣ�����ԭ����KNO3����Ϊ����������ԭ����ΪK2S��N2��CԪ�ػ��ϼ����ߣ���������CΪ��ԭ����CO2Ϊ���������3���������������������������·���������ԭ��Ӧ���ɶ�����̼�������Ӻ�ˮ����Ӧ�в��������ԭ������������������������ϼ���������С������Ϊ10������������۲취��ƽ���ӷ���ʽ�ɵã�5C2O42��+2MnO4-+16H+=2Mn2++10CO2��+8H2O.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������8.12����ը�¹��У���ը��������軯��й©������ͨ������˫��ˮ�������������Һ���������Լ��ỷ����Ⱦ��
���ϣ��軯�ƻ�ѧʽNaCN��CԪ��+2�ۣ�NԪ�ة�3�ۣ�����ɫ�ᾧ�������綾��������ˮ��ˮ��Һ�ʼ��ԣ���ˮ�������軯�⣮
(1)NaCNˮ��Һ�ʼ��ԣ���ԭ����_____�������ӷ���ʽ���ͣ���
(2)NaCN��˫��ˮ��������һ����ʽ�κ�һ����ʹʪ���ɫʯ����ֽ���������壬д���÷�Ӧ�Ļ�ѧ����ʽ_____��
ij��ѧ��ȤС��ʵ�����Ʊ���������ƣ�Na2S2O3����������������������Һ��������軯�Ʒ�ˮ�ܷ����ŷš�
��ʵ��һ��ʵ����ͨ����ͼװ���Ʊ�Na2S2O3��
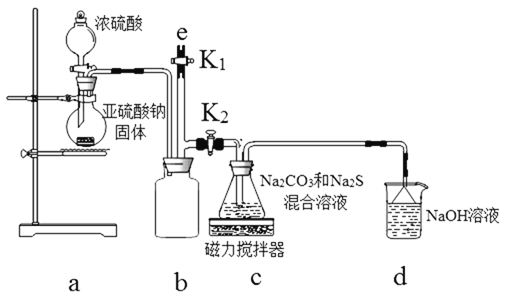
(3)aװ����ʢNa2SO3��������������ǣ�__________ ��bװ�õ�������_________
(4) cװ���еIJ�����Na2S2O3��CO2�ȣ�dװ���е�������NaOH��Na2CO3����������__________��
(5)ʵ���������e���������ʢ_____��ѡ����NaOH��Һ������ˮ������CCl4������һ�֣���ע�������ٹر�K2��K1����ֹ���װ��ʱ��Ⱦ������
��ʵ������ⶨ�������������Һ������ķ�ˮ���軯�Ƶĺ�����
��֪��Ag++2CN-=��Ag(CN)2��-��Ag++I-= AgI�� AgI�ʻ�ɫ��CN-������Ag+��Ӧ��
ʵ�����£�
ȡ25.00mL��������軯�Ʒ�ˮ����ƿ�У����μӼ���KI��Һ��ָʾ������1.000��10-4mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ2.5ml
(6)�ζ��յ���жϷ�����_________________��
(7)������ķ�ˮ�軯�Ƶĺ���Ϊ___________ mg/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҷ�����������Ե�����Ѫ�ܹ��ܡ��й������������ȷ����
A. ���ⲻ�ȶ��������ֽ�
B. ��������ɫ��ζ�����ж�������
C. �������������ԭ�ӵ�������Ӳ㶼�ﵽ8�����ȶ��ṹ
D. ����������ˮ�γ�һ�����ᣬ����뷽��ʽ��H2S ![]() 2H+ + S2-
2H+ + S2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2CO3��NaHCO3�����Һ����μ���ϡ���ᣬ�����������������������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ�������
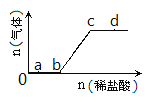
A. a���Ӧ����Һ�У�Na+��OH����SO42����NO3��
B. b���Ӧ����Һ�У�Al3+��Fe3+��MnO4����Cl��
C. c���Ӧ����Һ�У�Na+��Ca2+��NO3����Cl��
D. d���Ӧ����Һ�У�F����NO3����Fe2+��Ag+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������̫���ܵ�ز��ϣ������ܾ������ǽ����ڸ�����������ϻ����ϵġ���ҵ�Ͽ�������ͼ��ʾ��������ȡ�ߴ��衣

��1���������ڱ��е�λ����_______________����Ӧ1���������뻹ԭ�������ʵ���֮��Ϊ��__________________
��2���ֹ���HCl��Ӧ��ȫ��,�������õ���SiHCl3 (�е�31.8��)�к�������SiCl4 (�е�57.6��)��SiH2Cl2 (�е�8.2��)��SiH3Cl(�е�-30.4��)�ᴿSiHCl3���õķ���Ϊ__________�����������п���ѭ�����õ�����X�ǣ�_____________���ѧʽ��
��3���ᴿ�ֹ�Ĺ����б����ϸ������ˮ������ԭ��֮һ�ǹ��±���K��ˮ�⣬д��SiCl4��ˮ���ҷ�Ӧ�Ļ�ѧ����ʽ___________________________________
��4��������HNO3���ڵ������£�������HF����H2SiF6��ͬʱ�в�����ˮ���������ɣ���������������Ϊ����ɫ���赥�ʷ����Ļ�ѧ����ʽΪ_____________________________________________________
��5��ij������100�ִ���Ϊ75%��ʯӢɰΪԭ�Ͼ���һ����Ӧ�ƵõĴֹ��к���28�֣���ù����й�IJ����ǣ�__________����ȷ��С�������λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У�Na+ Ũ�������� �� ��
A. 4L 0.5 mol/L NaCl ��Һ B. 1mL 0.3 mol/L Na2SO4 ��Һ
C. 0.8L 0.4 mol/L NaOH ��Һ D. 3L 0.15 mol/L Na3PO4 ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�������Ͻ��˵���У���������
A.Ӳ������ͭ������ֶ����ںϽ𣬺Ͻ�������������ڴ����������۵���ڳɷֽ���
B.�Ͻ������������Ǹ֣��京̼��Խ������Խ��
C.��������Ʒ���渲�������ܵ�����Ĥ�����ڲ������𱣻�����
D.����ͭ��ˮ��Һ���ж����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ѧ��ѧѧϰ���ص㡣��ش��������⣺
��1����ѧ��ѧ������������Ũ���Ṳ�ȿ��Ʊ�SO2���壬д����Ũ���ỹ���Ʊ���ͬ������������ƣ�_____________________дһ�֣���
��2��ij��ѧ��ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ�Լ�SO2�����ʣ�����ͼ��ʾװ�ý����й�ʵ�顣

��װ��B�������������������塣B��Ӧ���õ�Һ����_______���������
a������Na2SO3��Һ b������ KMnO4��Һ
c��Ũ��ˮ d������NaHSO3��Һ
�ڷ�Ӧ��Ϻ���ƿ�л���һ���������ᣬʹ������������ҩƷ��������֤����Ӧ���������ƿ�е�ȷ���������____�����������
a��Fe�� b��BaCl2��Һ c��CuO d��Na2CO3��Һ
��ʵ����ijѧ����A�з�Ӧ����Һ��ͨ��һ�ֳ������嵥�ʣ�ʹͭƬȫ���ܽ��ҽ���������ͭ��Һ���÷�Ӧ�Ļ�ѧ����ʽ��_________��
��Ϊ��֤��������Ļ�ԭ�ԣ�C��ʢ����ˮ����ַ�Ӧ��ȡC�е���Һ�ֳ����ݣ��ֱ��������ʵ�飺
����I�����һ����Һ�м���AgNO3��Һ���а�ɫ��������
����������ڶ�����Һ����Ʒ����Һ����ɫ��ȥ
�����������������Һ����BaCl2��Һ��������ɫ����
���������к�������___������I����������������C�з�����Ӧ�����ӷ���ʽΪ____________��D��ʢ������������Һ����ͨ������������Թ�D����Һ������ʱ������Һ��c��Na+��=______���ú�����Ũ�ȵĴ���ʽ��ʾ����
��3������FeCl3��Һ��������Ҳ��������SO2���÷�Ӧ�����ӷ���ʽ��_____________������FeCl3�Ƿ���ȫ����ԭ�ķ���Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3��һ�ֻ���ԭ�ϣ�����ͨ����Ӧ����һϵ�����ʣ�����ͼ��ʾ��

����˵����ȷ���ǣ� ��
A. Cl2��SO2������Ư����ɫ���ʣ���Ư��ԭ����ͬ
B. ��SiO2+ Na2CO3![]() Na2SiO3+ CO2����֪H2CO3������ǿ��H2SiO3
Na2SiO3+ CO2����֪H2CO3������ǿ��H2SiO3
C. ��ҵ�ϣ�������ʳ��ˮ��ͨ��NH3����ͨ��CO2��NaHCO3
D. ��ȡ�����������Ư�����漰�ķ�Ӧ���Ƿ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com