
【题目】碳捕集封存作为减少温室气体排放的一种手段,受到许多国家的重视,将捕获的二氧化碳转化为可用产品将促进这技术的推广使用。
I.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图装置(部分条件及物质末标出)。

(1)在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________,可以循环利用的物质是___________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3溶液的热化学方程式为____________ 。
(3)下列溶液中,同样能用于“捕捉”二氧化碳的是________(填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
II.在海洋碳循环中,通过如图所示的途径固碳。

(1)写出钙化作用的离子方程式:______________。
(2)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理:________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________。
【答案】 增加氢氧化钠与二氧化碳的接触面积,提高了氢氧化钠溶液对二氧化碳的吸收率 氢氧化钠与氧化钙 CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4ab)kJ/mol D ![]() +Ca2+=CaCO3↓+CO2↑+H2O a室接电源的正极,为阳极,发生反应2H2O4e-=O2+4H+;氢离子通过阳离子交换膜进入b室,发生反应H++
+Ca2+=CaCO3↓+CO2↑+H2O a室接电源的正极,为阳极,发生反应2H2O4e-=O2+4H+;氢离子通过阳离子交换膜进入b室,发生反应H++![]() =H2O+CO2↑ 用c室排出的碱液将从b室排出的酸性海水调节至适当的pH
=H2O+CO2↑ 用c室排出的碱液将从b室排出的酸性海水调节至适当的pH
【解析】分析:I.根据题干提供的信息进行分析,捕捉室中含有氢氧化钠溶液,氢氧化钠能与二氧化碳反应生成碳酸钠和水;氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以高温分解生成氧化钙和二氧化碳,据此解答。
II. 本题考查海水的综合利用以及原电池和电解池的工作原理。
详解: I. (1) 在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了增加氢氧化钠与二氧化碳的接触面积,提高了氢氧化钠溶液对二氧化碳的吸收率; 在循环的过程中,氧化钙和氢氧化钠都可以循环利用,故填:氧化钙、氢氧化钠;
(2) 根据表中数据写出对应的反应为:
① ![]() CO2(g)+
CO2(g)+![]() NaOH(aq)=
NaOH(aq)= ![]() Na2CO3(aq)+
Na2CO3(aq)+![]() NaHCO3(aq)+
NaHCO3(aq)+![]() H2O(l) ΔH=akJ/mol;
H2O(l) ΔH=akJ/mol;
②CO2(g)+2NaOH(aq)= Na2CO3(aq)+ H2O(l) ΔH=bkJ/mol;
根据盖斯定律:①×4-②得:CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4ab)kJ/mol;
因此,本题答案为:CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4ab)kJ/mol
(3)碳酸钠溶液能吸收二氧化碳,故本题选D。
II.(1)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:Ca2++2HCO3-= CaCO3↓+CO2↑+H2O;
(2)①a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;
本题答案为:a室接电源的正极,为阳极,发生反应2H2O4e-=O2+4H+;氢离子通过阳离子交换膜进入b室,发生反应H++![]() =H2O+CO2↑
=H2O+CO2↑
②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. MgCl2的摩尔质量为95g
B. 18g H2O含有的原子总数为3NA
C. 0.5mol H2所占体积约为11.2L
D. 0.1 mol·L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。

回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,乙装置中品红溶液褪色,说明SO2具有_________性,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性。
(3)丁装置中发生主要反应的化学方程式:____________________________________________;其作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置电解硫酸铜和氯化钠的混合溶液,当线路中有1.20mol电子通过时,甲电极增重并有4.48L(已折算成标准状况下的体积,后同)气体生成,乙电极同时生成气体7.84L,则原溶液中硫酸铜与氯化钠的物质的量之比为
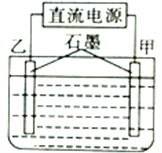
A. 2:1 B. 4:1 C. 2:3 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素C与过渡元素Co、Fe等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布式为_______,第四电离能I4(Co)<I4(Fe),其原因是_________。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______。
(3)治疔铅中毒可滴注依地酸,使Pb2+转化为依地酸铅盐。如图,下列说法正确的是____(填序号)。

A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)Fe(CO)x常温下是液态,熔点为-20.5℃,沸点为103℃,易容于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=______。
(5)Co的一种氧化物的晶胞如图.己知钴原于的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的_____(填“正八面体”“正四面体”或“立方体”)空隙中,在该钴的氧化物晶胞中原子的空间利用率为______(均用含a、b的计算表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种工业化工原料。无色透明的带刺激性臭味的液体,在潮湿空气中剧烈发烟。某化学小组采用PCl3氧化法制备POCl3。已知:POCl3的熔点为-112℃,沸点为75.5℃。在潮湿空气中二者均极易水解面剧烈“发烟”。回答下列问题:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制取氯气。发生装置可以选择图中的_____(填字母代号)。
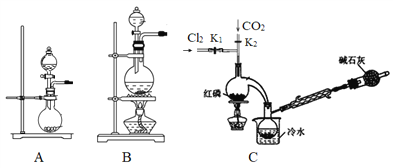
(2)检查装置气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。通干燥CO2的作用是_______。
II.制备POCl3(如图)
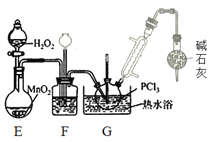
(3)盛放碱石灰的仪器的作用是________,装置G中发生反应的化学方程式为________ 。
(4)装置F的作用除观察O2的流速之外,还有________。
III.测定POCl3含量
实验制得的POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度:
①快速称取5.000g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/LNa2S2O3溶液8.00mL.
已知:H3PO3+I2+H2O==H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6.
(5)滴定终点的现象为__________。该产品的纯度为________。
(6)若滴定管在滴定前无气泡,滴定后有气泡,则测定结果______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种重要的有机合成中间体,由化合物A合成H的一种路线如下:
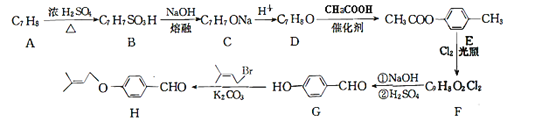
已知:RCHCl2 ![]() RCHO回答下列问题:
RCHO回答下列问题:
(1)A的化学名称为___________。
(2)G生成H的反应类型为__________,F中官能团名称是_____________。
(3)由A生成B的化学方程式____________________________,合成过程中D生成E的作用是_____________________。
(4)满足下列条件的H的同分异构体有________种,写出其中核磁共振氢谱有4组峰,且峰面积比为6:2:2:1:1:1:1的结构简式___________。
①能够发生银镜反应,能够发生水解反应,水解后的产物能与FeCl3溶液发生显色反应
②分子中只有一个环 ③苯环上有两个取代基,分子中含有两个甲基。
(5) 己知![]() ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的路线__________。
的路线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com