
浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)═CaCl2+Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O(气) ④O2.
A. ①②③④ B. ②③④ C. ②③ D. ①④
考点: 氯、溴、碘及其化合物的综合应用.
专题: 卤族元素.
分析: 浓盐酸易挥发,贮存很久的漂白粉可能存在碳酸钙,从溶液中生成的气体中会混有水,以此来解答.
解答: 解:贮存很久的漂白粉可能存在碳酸钙,加盐酸发生Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O、CaCO3+2HCl=CaCl2+CO2↑+H2O,
浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
如在光照条件下进行,生成的HClO见光分解,可生成氧气.
故选A.
点评: 本题考查物质的制备,把握物质的组成及发生的化学反应为解答的关键,注意贮存很久的漂白粉会变质及浓盐酸易挥发,注 重基础知识的考查,题目难度不大.
重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一.
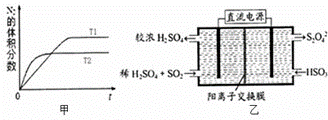
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图甲所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H 0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)= .该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为 .
(2)利用如图乙所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32﹣生成.该反应中氧化剂与还原剂的物质的量之比为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol•L﹣1的醋酸与b mol•L﹣1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)═c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka= (用含a和b的代数式表示).
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42﹣互为等电子体的分子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生需要用烧碱固体配制0.5mol•L﹣1的NaOH溶液500mL.实验室提供以下仪器:①100mL烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码).请回答下列问题:
(1)计算结果:需要称取NaOH固体10g;
(2)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 、 .(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次) ;
A.用少量水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于 、后用于 ;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是 ;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理? .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中关于物质分类的正确组合是()
类别组合 酸性氧化物 碱性氧化物 酸 碱 盐
A CO2 CuO H2SO4 NH3•H2O Na2S
B CO Na2O HCl NaOH NaCl
C SO2 Na2O2 CH3COOH KOH CaF2
D NO2 CaO HNO3 Cu(OH)2CO3 CaCO3
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
还原2.4×10﹣3 mol XO(OH)3+到X元素的低价态时,消耗0.2mol•L﹣1的Na2SO3溶液30mL,则X元素反应后的价态是()
A. +1 B. ﹣1 C. 0 D. ﹣2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升•分)表示,则正确的关系是()
A. 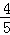 ν(NH3)=ν(O2) B.
ν(NH3)=ν(O2) B. 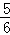 ν(O2)=ν(H2O) C.
ν(O2)=ν(H2O) C. 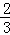 ν(NH3)=ν(H2O) D.
ν(NH3)=ν(H2O) D. 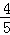 ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯酚能跟碳酸钠溶液反应生成苯酚钠.现有如下转化:
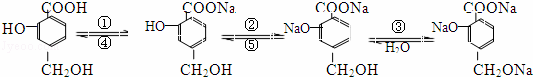
根据上述转化关系回答下列问题:
(1)a.羧基 b.酚羟基 c.醇羟基提供质子的能力是(填编号) .
(2)①~⑤编号所用的试剂分别是:① ;② ;③ ;④ ;⑤ .
(3)写出苯酚与碳酸钠溶液反应的离子方程式 .
(4)写出乙醇钠与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:填空题
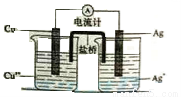
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
A.Ag与空气中的氧气反应生成氧化银
B.Ag与空气中的含硫化合物反应生成硫化银
C.Ag与空气中氧及含硫化合物反应生成硫化银
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)如图下所示原电池正极的反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com