
ĻĀĮŠÓŠ¹ŲČČ»Æѧ·½³ĢŹ½µÄŠšŹöÕżČ·µÄŹĒ
A£®ŅŃÖŖ2H2O(g) £½2H2(g)£«O2(g) ”÷H£½+483.6 kJ/mol£¬ŌņĒāĘųµÄČ¼ÉÕČČĪŖ
”÷H£½£241.8kJ/mol
B£®ŅŃÖŖC£ØŹÆÄ«£¬s£©£½ C£Ø½šøÕŹÆ£¬s£©”÷H£¾0£¬Ōņ½šøÕŹÆ²»ČēŹÆÄ«ĪȶØ
C£®ŅŃÖŖÖŠŗĶČČĪŖ”÷H£½£57£®4kJ/mol £¬ŌņĻ”“×ĖįŗĶĻ”NaOHČÜŅŗ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½
ĪŖ£ŗNaOH(aq)£«CH3COOH(aq)£½CH3COONa(aq)£«H2O(l) ”÷H£½£57.4kJ/mol
D£®ŅŃÖŖ2C(s)£«2O2(g)£½2CO2 (g) ”÷H1£»2C(s)£«O2 (g)£½2CO(g) ”÷H2£¬Ōņ”÷H1£¾”÷H2
 ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµŠĀ½®ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµŠĀ½®ČĖĆń³ö°ęÉēĻµĮŠ“š°ø Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Óµ¼ÓėĮ·Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø
Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Óµ¼ÓėĮ·Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø Š”ѧŹī¼Ł×÷Ņµ¶«ÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
Š”ѧŹī¼Ł×÷Ņµ¶«ÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø ½ņĒŽĢÓżŹī¼Ł°ĪøßĻĪ½Ó¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
½ņĒŽĢÓżŹī¼Ł°ĪøßĻĪ½Ó¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø ²Ø²ØŠÜŹī¼Ł×÷Ņµ½Ī÷ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
²Ø²ØŠÜŹī¼Ł×÷Ņµ½Ī÷ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŹµŃéĻÖĻóµÄĆčŹöÕżČ·µÄŹĒ
A£®ĒāĘųŌŚĀČĘųÖŠČ¼ÉÕ£¬·¢³ö²Ō°×É«»šŃę£¬ĘææŚÉĻ·½ÓŠ°×É«ŃĢĪķ
B£®ĢśĖæŌŚĀČĘųÖŠČ¼ÉÕ£¬²śÉś×ŲŗÖÉ«µÄÅØŃĢ£¬²śĪļČÜÓŚĖ®£¬ČÜŅŗ³ŹĒ³ĀĢÉ«
C£®ĶŌŚĀČĘųÖŠČ¼ÉÕ£¬²śÉś×Ų»ĘÉ«ŃĢ£¬²śĪļČÜÓŚĖ®£¬ČÜŅŗ³ŹĄ¶ĀĢÉ«
D£®ÄĘŌŚĀČĘųÖŠČ¼ÉÕ£¬·¢³ö»ĘÉ«µÄ»šŃę£¬Éś³É»ĘÉ«¹ĢĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓĆCH4“߻ƻ¹ŌNOxæÉŅŌĻū³żµŖŃõ»ÆŗĻĪļµÄĪŪČ¾”£ĄżČē£ŗ
¢ŁCH4£Øg£©+4NO2£Øg£©=4NO£Øg£©+CO2£Øg£©+2H2O£Øg£©£»”÷H=£574kJ/mol
¢ŚCH4£Øg£©+4NO£Øg£©=2N2£Øg£©+CO2£Øg£©+2H2O£Øg£©£»”÷H=£1160kJ/mol
ĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ£Ø £©
A£®µČĪļÖŹµÄĮæµÄCH4ŌŚ·“Ó¦¢Ł”¢¢ŚÖŠ×ŖŅʵē×ÓŹżĻąĶ¬
B£®ÓÉ·“Ó¦¢ŁæÉĶĘÖŖ£ŗCH4£Øg£©+4NO2£Øg£©=4NO£Øg£©+CO2£Øg£©+2H2O£Øl£©£»”÷H>£574kJ/mol
C£®4NO2£Øg£©+2N2£Øg£©=8NO£Øg£©£»”÷H=+586kJ/mol
D£®ČōÓƱź×¼×“æöĻĀ4.48L CH4°ŃNO2»¹ŌĪŖN2£¬Õūøö¹ż³ĢÖŠ×ŖŅʵĵē×Ó×ÜŹżĪŖ1.6NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ»Æѧ·“Ó¦ŌŚŅ±½š¹¤ŅµÖŠĆ»ÓŠµĆµ½¹ć·ŗÓ¦ÓƵďĒ(””””)
A.MgCl2(ČŪČŚ) Mg+Cl2”ü
Mg+Cl2ӟ
B.Al2O3+3C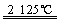 2Al+3COӟ
2Al+3COӟ
C.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
D.HgS+O2 Hg+SO2
Hg+SO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ķ¼°ĘäŗĻ½šŌŚÉś²śŗĶÉś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓ¦ÓĆ”£Ķŗ¬ĮæŗÜøßµÄĶŗĻ½š³Ę×ĻĶ»ņŗģĶ;ŅŌŠæĪŖÖ÷ŅŖĢķ¼ÓŌŖĖŲµÄĶŗĻ½š³Ę»ĘĶ;ŅŌÄųĪŖÖ÷ŅŖĢķ¼ÓŌŖĖŲµÄĶŗĻ½š³Ę°×Ķ;»ĘĶÖŠŗ¬ÓŠÉŁĮæÄų³ĘÄų»ĘĶ”£
Ä³Ń§Ļ°Š”×éÄā¶ŌÉĻŹöĶ¼°ĘäŗĻ½š½ųŠŠĢ½¾æ”£
(1)ĶµÄŗĖĶāµē×ÓÅŲ¼Ź½:””””””””””””,ÄųŌŚÖÜĘŚ±ķÖŠĪ»ÓŚ””””””ÖÜĘŚ”¢
””””””×唣
(2)ĻÖӊijÖÖĶŗĻ½š,¾²ā¶Øŗ¬ÓŠÄųŌŖĖŲ,¶ŌøĆĶŗĻ½šĄąŠĶ×÷ČēĻĀĢ½¾æ:
¼ŁÉčŅ»:øĆĶŗĻ½šŹĒ”””””””””””””£
¼ŁÉ趞:øĆĶŗĻ½šŹĒ”””””””””””””£
(3)ĪŖČ·¶ØøĆĶŗĻ½šµÄ×é³É,Äć»¹ŠčŅŖ½ųŠŠµÄŹµŃé:
| ŹµŃé²½Öč | Ō¤ĘŚŹµŃéĻÖĻóŗĶ½įĀŪ |
| ¢ŁÓĆļ±µ¶½«ĶŗĻ½š“ģ³É·ŪÄ©,³ĘČ”Ņ»¶ØÖŹĮæµÄĶŗĻ½š·ŪÄ© | |
| ¢Ś | |
| ¢Ū |
ŅŃÖŖ:ÄųŗĶĢśŠŌÖŹĻąĖĘ,ŠæŗĶĀĮŠŌÖŹĻąĖĘ”£
±ķÖŠŹµŃé²½ÖčæÉŅŌ²»ĢīĀś,Ņ²æÉŅŌ×ŌŠŠĢķ¼Ó”£
(4)Č”1.50 gøĆĶŗĻ½š,Óė×ćĮæ¼ī·“Ó¦²śÉśĘųĢåĢå»ż(ŅŃ¾ÕŪĖć³É±ź×¼×“æöĻĀµÄĢå»ż)µÄĶ¼ĻńČēĶ¼ĖłŹ¾,øĆŗĻ½šŗ¬ŠæÖŹĮæ·ÖŹż””””””””(Š”Źżµćŗó±£ĮōŅ»Ī»Źż×Ö)”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Šæ—æÕĘųµē³ŲæÉÄܳÉĪŖĪ“Ą“µÄĄķĻė¶ÆĮ¦Ō“£¬øƵē³ŲµÄµē½āÖŹČÜŅŗæÉŅŌŹĒĖįŠŌ»ņ¼īŠŌ”£ŌŚ¼īŠŌČÜŅŗÖŠøƵē³Ų×Ü·“Ó¦æɱķŹ¾ĪŖ£ŗ2Zn£«4NaOH£«O2===2Na2ZnO2 £«2H2O”£ĻĀĮŠÓŠ¹ŲŠæ£æÕĘųµē³ŲĖµ·ØÕżČ·µÄŹĒ
A£®¼īŠŌµē½āÖŹČÜŅŗÖŠÕż¼«·“Ó¦Ź½ĪŖ£ŗ4OH£- 4e£=== O2”ü£«2H2O
B£®¼īŠŌ»ņĖįŠŌµē½āÖŹČÜŅŗÖŠ£¬øƵē³ŲÕż¼«·“Ó¦Ź½ĻąĶ¬
C£®øƵē³Ų¹¤×÷Ź±£¬Na£«ŅĘĻņøŗ¼«
D£®ĆæÉś³É1 mol ZnO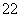 ×ŖŅʵē×ÓŹżĪŖ2NA
×ŖŅʵē×ÓŹżĪŖ2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
øł¾ŻÓŅĻĀ±ķŹż¾Ż£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
| µēĄė³£Źż(25”ę) |
| HF£ŗ Ki = 3.6”Į10 - 4 |
| H3PO4£ŗ Ki1= 7.5”Į10 -3£¬ Ki2= 6.2”Į10 -8£¬ Ki3= 2.2”Į10 -13 |
A. ŌŚµČÅØ¶ČµÄNaF”¢NaH2PO4»ģŗĻČÜŅŗÖŠ£¬
c(Na+)+c(H+)=c(F£)+ c(H2PO4£)+ c(OH£)
B. ÉŁĮæH3PO4ŗĶNaF·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ:
H3PO4 +F£= H2PO4£+HF
C. Ķ¬ĪĀĶ¬ÅØ¶ČŹ±£¬ČÜŅŗµÄpH£ŗNaF£¾NaH2PO4£¾Na2HPO4
D. ½įŗĻH+ µÄÄÜĮ¦£ŗH2PO4££¾ HPO42££¾F£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹÖŠ£¬²»ÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«µÄĪļÖŹŹĒ
(””””)”£
¢Ł ””¢ŚŅŅĻ©””¢ŪCH3COOH””¢ÜCH3CH2OH¢ŻCH2===CH”ŖCOOH””¢Ž
””¢ŚŅŅĻ©””¢ŪCH3COOH””¢ÜCH3CH2OH¢ŻCH2===CH”ŖCOOH””¢Ž
A£®¢Ł¢Ż B£®¢Ł¢Ś¢Ü¢Ž C£®¢Ł¢Ü D£®¢Ł¢Ū¢Ž
””””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĪļÖŹ£¬¼Č²»ŹĒĶ¬ĻµĪļÓÖ²»»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄŹĒ(””””)
¢ŁÕįĢĒŗĶĀóŃæĢĒ””¢ŚČķÖ¬ĖįøŹÓĶõ„ŗĶÓ²Ö¬ĖįøŹÓĶõ„
¢Ūµķ·ŪŗĶĻĖĪ¬ĖŲ””¢ÜÓĶĖįøŹÓĶõ„ŗĶŅŅĖįøŹÓĶõ„
A£®¢Ł¢Ś B£®¢Ū¢Ü C£®¢Ł¢Ū D£®¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com