
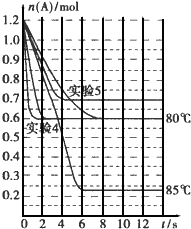
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2?g-1 |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | ||||||
| 实验5目的: | 1 |
| △c |
| t |
| A的浓度变化量 |
| A的起始浓度 |
| 1.2mol |
| 2L |
| 0.75 |
| 2L |
| 0.225mol/L |
| 4s |
| A的浓度变化量 |
| A的起始浓度 |
| 0.225mol/L |
| 0.6mol/L |
(
| ||
|
| 实验编号及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2?g-1 |
| 2 | 80 | 1.2 | 0 | a | 2b(或nb(n>1)) | |
| 实验5目的:压强对反应速率的影响 | 80 | 1.2 | 0 | a | b |
 ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、原混合物中铜和铁各0.075 mol |
| B、稀硝酸的物质的量浓度为2.0 mol?L-1 |
| C、第一次剩余4.8 g 金属为铜和铁 |
| D、向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4molNaCl所含离子数 |
| B、标准状况下5.6L CO2所含原子数 |
| C、1L1 mol?L-1盐酸所含HCl分子数 |
| D、10g氖气所含原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
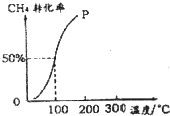 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
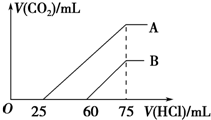 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:
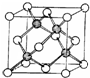 A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
| V | V的单质是淡黄色固体,是黑火药的一种主要成分 |
| W | W的单质是人们最早发现和使用的金属之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A、同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 |
| B、结合H+ 的能力:ClO->CO32->F- |
| C、碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑ |
| D、次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O=HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
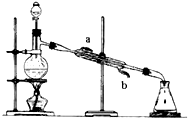 如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.
如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com