
| A、肯定没有NH4+、HCO3-、Ba2+ |
| B、可能有K+、Cl-、HCO3- |
| C、肯定有Al3+、Mg2+、SO42-、NH4+ |
| D、若另取部分原溶液加入足量AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- |


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
| A、2 4 3 2 2 6 |
| B、0 2 1 0 1 2 |
| C、2 0 1 2 0 2 |
| D、2 10 6 2 5 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
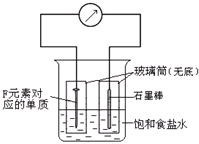 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试样 | 所加试剂 | 实验现象及测定数值 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加过量的盐酸酸化的BaCl2溶液 | 白色沉淀0.932g |
| 第三份试液 | 滴加0.01mol/LNaOH溶液体积V,与生成沉淀的关系,如右图 | 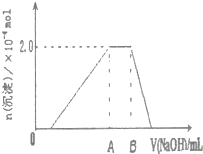 |
| 第四份试液 | 滴加过量的AgNO3 | 白色沉淀1.535g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2 (SO4)3 |
| B、O2 |
| C、Cu (NO3)2 |
| D、FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com