
【题目】两种气态烷烃的混合物,在标准状况下其密度为1.03 g·L-1 ,则关于该混合物组
成的说法正确的是( )
A. 一定有甲烷 B. 一定有乙烷
C. 不可能是甲烷和乙烷的混合物 D. 可能是乙烷和丙烷的混合物
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。请回答:
2NH3(g) ΔH=92.4 kJ·mol1。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是______(填字母)。
a.用铁作催化剂加快化学反应速率
b.采用较高压强(20 Mpa~50 MPa)
c.增大N2的浓度提高H2的转化率
d.合成氨时采用循环操作
e.加热到500℃
(2)合成氨反应达到平衡时,用H2表示的正反应速率为v正(H2),用NH3表示的逆反应速率为v逆(NH3),二者满足的关系式为_______________。
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中tl时引起平衡移动的条件可能是____________。其中表示平衡混合物中NH3的含量最高的一段时间是____________。

(4)温度为T℃时,将2 mol H2和1 mol N2加入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则平衡时H2的浓度为____________。
(5)当温度升高时,反应的化学平衡常数K值_________(填“增大”“减小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出2016年十大创新技术:碳呼吸电池、量子卫星、万能抗病毒药……,“碳呼吸电池”是一种新型能源装置,其工作原理如图。下列有关说法错误的是( )

A. 该装置是将化学能转变为电能
B. 金属铝是负极,多孔碳是正极
C. 正极的电极反应为2CO2-2e-=C2O42-
D. 将电池配备在火力发电站和汽车排气管上,不但可减少 CO2排放,而且还可以利用CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在带有活塞的密闭容器中发生反应:Fe2O3+3H2=2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A. 增加Fe2O3的量 B. 保持容器体积不变,增加H2输入量
C. 减少Fe的量 D. 保持容器体积不变,增加H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )
A. 加少量CH3COONa固体 B. 加硝酸钾固体
C. 不用铁片,改用铁粉 D. 不用稀硫酸,改用98%浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质发生化学变化都伴随着能量变化
B. 任何反应中的能量变化都表现为热量变化
C. 伴有能量变化的物质变化都是化学变化
D. 没有物质的变化,就不会有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的
是___________。
A.①>②>③ B.③>①>② C.②>③>① D.③>②>①
(3)用铂电极电解一定浓度的下列物质的水溶液,在电解后的溶液中加适量水,能使溶液浓度恢复到电解前浓度的是___________。
A.NaOH B.CuSO4C.K2S D.NaCl
(4)比较填空(选填“>"或“ <"或"=”)
①2H2(g)+O2(g)= 2H2O(g)△H1和2H2(g)+O2(g)= 2H2O(l)△H2的△H大小:△H1 __________△H2。
②等体积等PH的溶液:a.盐酸 b.硫酸,分別与足量NaOH溶液反应,消耗NaOH的物质的
量多少:a___________b。
③常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a__________b。
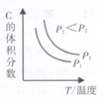
④已知某可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
(5)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) ![]() CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________。
②反应为___________反应(填“吸热”或“放热”)。
③某温度下,平衡时各物质的浓度有如下关系:3[c(CO2)c(H2)] =5[c(CO)(H2O)],判断此时的反应温度为___________℃。
④800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正___________ v逆(填“>"或“<”或“=”)
(6)下图所示为用惰性电极电解100mL 0.5mol·CuSO4溶液的装置,b电极上的电极反应式为______。若a电极共产生56mL(标准状况)气体,则所得溶液的pH =___________(不考虑溶液体积变化)。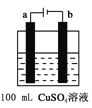
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com