
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
【答案】C
【解析】
由图可知,向200 mL FeBr2溶液中通入0.1mol氯气时,Fe2+恰好被完全氧化为Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,由方程式可得n(Fe2+)为0.2mol,则n(Br-)为0.4mol;通入氯气0.3mol时,溶液中0.4mol Br-恰好被完全氧化为Br2,反应的离子方程式为2Br-+ Cl2=Br2 + 2Cl-,则氯气与溴化亚铁溶液完全反应的离子方程式为2Fe2++4Br- + 3Cl2=2Fe3++2Br2 +6Cl-。
A项、由题给图示可知,向200 mL FeBr2溶液中通入氯气,亚铁离子先反应,说明还原性Fe2+> Br-,还原剂的还原性越强,对应氧化产物的氧化性越弱,则氧化性强弱:Br2 > Fe3+,故A正确;
B项、由通入0.1mol氯气时,Fe2+恰好被完全氧化为Fe3+可得,溶液中n(Fe2+)为0.2mol,则FeBr2溶液的浓度为![]() =1mol/L,故B正确;
=1mol/L,故B正确;
C项、当通入n(Cl2)为0. 12 mol时,0.2mol Fe2+已经完全被氧化为Fe3+,n(Fe3+)为0.2mol,过量的0. 02 mol Cl2与0. 04 mol Br-反应,溶液中n(Br-)为(0.4—0.04)mol=0.36mol,则溶液中的离子浓度有c (Fe 3+)∶c( Br-)= 0.2mol∶0.36mol=5:9,故C错误;
D项、n(FeBr2)∶n(Cl2)=1∶1时,溶液中Fe2+已经完全被氧化为Fe3+,有一半Br-被氧化为Br2,反应的离子方程式为2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-,故D正确;
故选C。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)的平衡常数K=2.5×107
(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对铁生锈进行研究。
(1)甲同学设计了 A、B、C三组实验如图:

探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是: A中铁钉生诱;b中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是______________________________;
②铁钉发生电化学腐蚀的正极电极反应式为______________________________;
③实验B所用的水要经过________处理,植物油的作用是_________________;
④实验C中碱石灰的作用是______________________。
(2)乙同学为了达到同样目的,设计了实验d如图所示:

发现一段时间后,试管中的液面升髙,其原因是____________________________,该实验_______(填“能”或“不能”)说明水对铁钉生锈产生影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质的制备流程如图,下列说法不正确的是( )

A.“煮沸”操作有利于I-的充分溶解
B.灼烧时用到的硅酸盐仪器为玻璃棒、蒸发皿、酒精灯。
C.氧化的步骤中发生的氧化还原反应:2I- + H2O2 + 2H+ = I2 + 2H2O
D.萃取分液中分液漏斗中萃取液的处理是:下层液体经旋塞放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. PE(聚乙烯)材料因其无毒且易降解,广泛用于食品包装
B. “投泥泼水愈光明”中蕴含的化学反应是炭与灼热水蒸气反应得到两种可燃性气体
C. “一带一路”被誉为现代“丝绸之路”。丝绸来自合成纤维,主要含C、H、O、N元素
D. 《天工开物》记裁制造青瓦“(窑)泥周寒其孔,浇水转釉”,红瓦转化为青瓦的原因是铁的其他氧化物转化为Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或用品:①铁架台(含铁圈、各式铁夹)②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒(普通) ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩漏斗;
现有下列药品:a.NaOH固体 b.标准NaOH溶液 c.未知浓度盐酸 d.蒸馏水e.碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是______________。
(2)做中和反应反应热的测定实验时,还缺乏的玻璃仪器有____________、___________。
(3)准确量取25.00ml碳酸钠溶液,可选用的仪器是__________。
A.25ml量筒 B.25ml酸式滴定管
C.25ml碱式滴定管 D.有刻度的50ml烧杯
(4)进行中和滴定时,不可预先用待装液润洗的仪器是下列的__________(填编号)。
A、酸式滴定管 B、碱式滴定管 C、锥形瓶
(5)用标准强碱溶液滴定盐酸时,滴定前,滴定管尖端有气泡,滴定后气泡消失,会使得测定的盐酸浓度结果_____________。(填“偏高”、“偏低”或“不影响”,下同)
(6)用标准强碱溶液去滴定未知浓度盐酸,用滴定管取10.00ml盐酸溶液入锥形瓶时,前仰视、后俯视读数,会使得测定的盐酸浓度结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究化学反应2Fe2++I2 ![]() 2Fe3++2I-,完成了如下实验:
2Fe3++2I-,完成了如下实验:
已知:Agl是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___________。
(2)Ⅲ中的黄色浑浊是___________。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。进一步探究表明产生Fe3+的主要原因是Fe2+被I2氧化。Fe3+产生的其它途径还可能是___________(用离子方程式表示)。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
(实验1)向1 mL0.1mol/L FeSO4溶液中加入1 mL0.1mol/LAgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
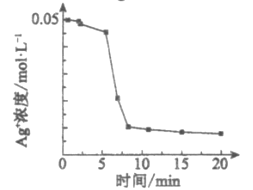
(实验2)实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
①实验1中发生反应的离子方程式是___________。
②通过以上实验,小组同学怀疑上述反应的产物之一可作反应本身的催化剂。则Ⅳ中几秒钟后即出现灰黑色浑浊的可能原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com