
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
分析 根据Cu2+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子守恒计算n(FeSO4),进而计算反应后溶液中Fe2+的物质的量,根据电荷守恒计算原溶液中n(Fe3+),根据Fe元素守恒,减去原溶液中Fe3+物质的量可得溶解Fe的物质的量,再根据m=nM计算溶解的铁粉的质量.
解答 解:n(SO42-)=0.1L×6mol•L-1=0.6mol,CuSO4、Fe2(SO4)3的溶液中阳离子的浓度相同,所以阳离子物质的量也相同,则有n(Cu2+)=n(Fe3+),
设Cu2+、Fe3+离子物质的量均为n,根据电荷守恒知道:2n+3n=0.6mol×2,由此解得n=0.24mol,
Cu2+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,
根据Fe元素守恒可知,此溶液最多溶解铁粉的物质的量为:0.6mol-0.24mol=0.36mol,
则此溶液最多溶解铁粉的质量为:0.36mol×56g/moL=20.16g,
故选D.
点评 本题考查混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意用电荷守恒和质量守恒解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
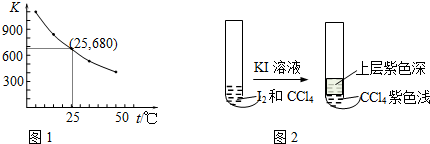
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
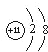 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
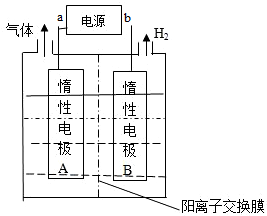
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
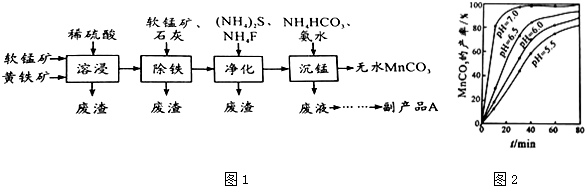
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
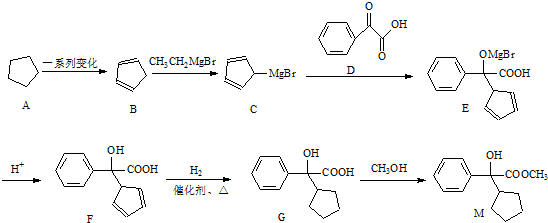
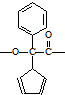
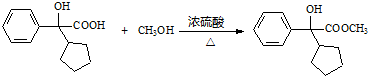 .
.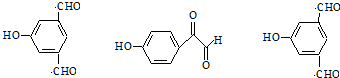 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com