
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A.H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物
B.HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸
C.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石
D.Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物
 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X<Z
C.最高价氧化物对应水化物的碱性:Y>W
D.Y、Z的氧化物都有酸性和碱性
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA
B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.1 mol Na被完全氧化生成Na2O2,失去2 NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是CO2(g)+3H2(g)? CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是
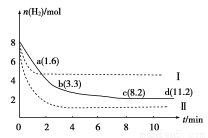
A.该反应在低温条件下能自发进行
B.曲线Ⅰ改变的条件可能是升高温度
C.若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是:K2 >K > K1
D.容器内气体平均摩尔质量不再改变说明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分)下表为部分短周期元素化合价及相应氢化物沸点的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
最高化合价 | +6 | +5 | +4 |
| +5 |
| +7 | +4 |
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是 (用表中元素编号填写)。
写出H的最高价氧化物的结构式: 。
(2)比较A、D、G三种简单阴离子的半径大小:r( )>r( )>r( )(均用实际的元素符号表示)。比较元素F、G的氢化物的沸点高低,并说明理由 。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)以下说法正确的是 (填编号)。
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的pH值来鉴别
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
下列关于反应速率的说法正确的是
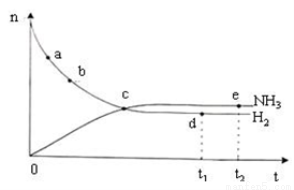
A.决定反应速率的主要因素是反应物的浓度
B.化学反应速率为0.8 mol /(L·s)是指1s 时某
物质的浓度为0.8mol/L
C.用不同物质的浓度变化表示同一时间内、同一
反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比
D.右上图表示密闭容器中673 K,30 MPa下的反应:N2(g)+3H2(g) 2NH3(g) △H<0, n(NH3)和n(H2)随时间变化的关系曲线图。点d(t1时刻)和点e(t2时刻)处n(N2)不一样
2NH3(g) △H<0, n(NH3)和n(H2)随时间变化的关系曲线图。点d(t1时刻)和点e(t2时刻)处n(N2)不一样
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:填空题
(18分)某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色。
提出问题 Fe3+、Br2谁的氧化性更强?
(1 )猜 想: ①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(3)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:
(填离子的化学式)。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
2014年9月28日,郑州市区被大雾笼罩,空气严重污染,其首要污染物为PM2.5。PM2.5是指大气中直径小于或等于2.5×10-6m的颗粒物,又称可入肺颗粒物。下列有关说法不正确的是
A.雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶,多出现于秋冬季节
B.焚烧秸秆和化石燃料的燃烧会增大空气中PM2.5的含量
C.PM2.5在空气中一定能产生丁达尔现象
D.开发利用新能源,实施“低碳经济”,可减少PM2.5的产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com