
| A. | 分别取两种固体样品,加热产生气体的是碳酸氢钠 | |
| B. | 分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠 | |
| C. | 分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠 | |
| D. | 分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸钠 |
分析 A.Na2CO3较稳定,受热不易分解,NaHCO3不稳定,受热易分解生成CO2、H2O; B.Na2CO3和CaCl2反应生成白色沉淀CaCO3,NaHCO3和CaCl2不反应;C.二者都能和Ca(OH)2反应生成白色沉淀CaCO3;
D.质量相同的这两种物质,NaHCO3的物质的量大于Na2CO3,再根据C原子守恒知,生成气体较多的是NaHCO3.
解答 解:A.Na2CO3较稳定,受热不易分解,NaHCO3不稳定,受热易分解生成CO2、H2O,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,所以可以鉴别,故A不选; B.Na2CO3和CaCl2反应生成白色沉淀CaCO3,反应方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,NaHCO3和CaCl2不反应,现象不同,可以鉴别,故B不选;
C.二者都能和Ca(OH)2反应生成白色沉淀CaCO3,反应方程式分别为:C.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,现象相同不能鉴别,故C选;
D.M(Na2CO3)>M(NaHCO3),所以相同质量时n(Na2CO3)<nM(NaHCO3),根据Na2CO3+H2SO4=Na2SO4+H2O+CO2↑、2NaHCO3+H2SO4=Na2SO4+H2O+CO2↑知,生成气体较多的是NaHCO3,该鉴别方法错误,故D选;
故选CD.
点评 本题物质鉴别实验方案设计,为高频考点,明确物质性质差异性是解本题关键,利用物质的差异性还可以除杂,注意BC反应现象的区别,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+)=c(NH4+ ) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c( H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->IO3->Cl2 | B. | BrO3->Cl2>IO3->ClO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
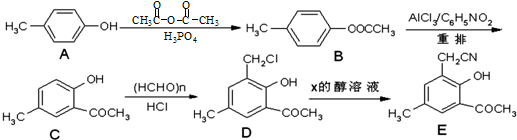
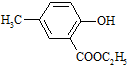
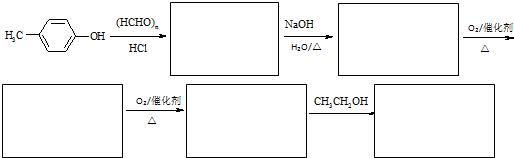
 (任写一种).
(任写一种). .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
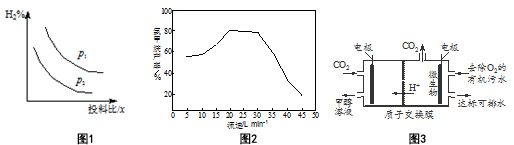
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠钾的合金在常温下是液体,可用于快中子反应堆热交换剂 | |
| B. | 漂白粉可以用来漂白、消毒杀菌.其有效成分是次氯酸钙 | |
| C. | 碳酸钠俗称纯碱,是焙制糕点所用的发酵粉的主要成分 | |
| D. | 镁和某些金属构成合金,硬度和强度都较大,可用于飞机、火箭等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 H2SO4>H3PO4 | B. | 热稳定性 H2S>H2O | ||
| C. | 碱性 NaOH>Mg(OH)2 | D. | 氧化性F2>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com