
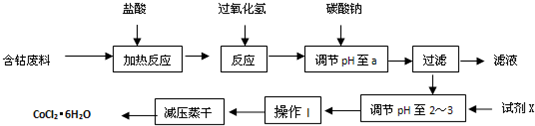
CoCl2��6H2O��һ������Ӫ��ǿ�������Ժ��ܷ��ϣ�������Fe��Al�����ʣ���ȡCoCl2��6H2O��һ���¹�����������ͼ��
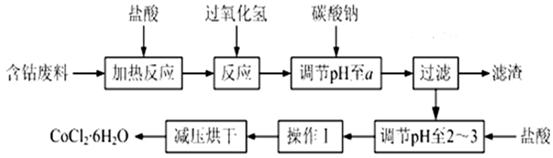
��֪�����������ᷴӦ�Ļ�ѧ����ʽΪ��Co��2HCl=CoCl2��H2��
��CoCl2��6H2O�۵�86�棬������ˮ�����ѵȣ��������ȶ�����������110~120��ʱ��ʧȥ�ᾧˮ����ж�����ˮ�Ȼ��ܡ�
�۲���������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| ��ʼ���� | 2.3 | 7.5 | 7.6 | 3.4 |
| ��ȫ���� | 4.1 | 9.7 | 9.2 | 5.2 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | ��ʼ���� | 2.3 | 7.5 | 7.6 | 3.4 | ��ȫ���� | 4.1 | 9.7 | 9.2 | 5.2 |
�鿴�𰸺ͽ���>>
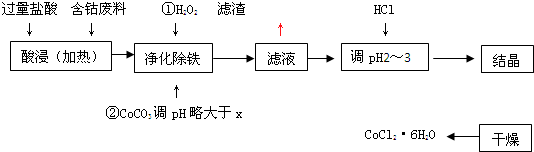
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧʽ | �ܶȻ�������ʱ��Ksp | ������ȫʱ��pH | �Ȼ��ܾ�������� |
| Co��OH��2 | 5.9��10-15 | 9.4 | CoCl2?6H2O�ʺ�ɫ���������ȶ���110��C��120��Cʱ��ˮ�����ɫ��ˮ�Ȼ��� |
| Fe��OH��2 | 1.6��10-14 | 9.6 | |
| Fe��OH��3 | 1.0��10-35 | x |
�鿴�𰸺ͽ���>>
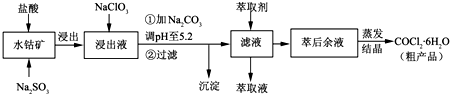
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
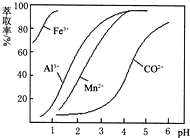
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 7.6 | 3.4 |
| ��ȫ���� | 4.0 | 9.7 | 9.2 | 5.2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com