设nA代表阿伏伽德罗常数的数值,下列说法正确的是( )
A.nA个一氧化碳分子和0.5mol甲烷的质量比为7:2
B.32gO3与nA个O2所含的氧原子数不同
C.46gNO2和46gN2O4含有的原子数之和为3nA
D.2.4g金属镁与足量的盐酸反应,生成氢气的分子数为nA
【答案】
分析:A、利用m=n×M来计算;
B、根据分子的构成来分析;
C、利用n=

及物质的构成来分析;
D、由Mg+2HCl═MgCl
2+H
2↑及n=
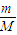
来分析.
解答:解:A、n
A个一氧化碳分子和0.5mol甲烷的质量比为1mol×28g/mol:0.5mol×16g/mol=7:2,故A正确;
B、32gO
3与的氧原子数为2n
A个,n
A个O
2所含的氧原子数也为2n
A个,即相同,故B错误;
C、因组成元素相同,原子的个数比相同,原子数为
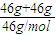
×3×n
Amol
-1=6n
A,故C错误;
D、Mg的物质的量为
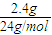
=0.1mol,由Mg+2HCl═MgCl
2+H
2↑,则生成氢气的分子数为0.1n
A,故D错误;
故选A.
点评:本题考查阿伏加德罗常数,题目难度不大,注意利用物质的组成、构成、质量、体积、微粒数目与物质的量的关系来解答此类题目时,常从以上几个角度考虑.

 及物质的构成来分析;
及物质的构成来分析;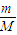 来分析.
来分析.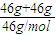 ×3×nAmol-1=6nA,故C错误;
×3×nAmol-1=6nA,故C错误;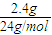 =0.1mol,由Mg+2HCl═MgCl2+H2↑,则生成氢气的分子数为0.1nA,故D错误;
=0.1mol,由Mg+2HCl═MgCl2+H2↑,则生成氢气的分子数为0.1nA,故D错误;
