
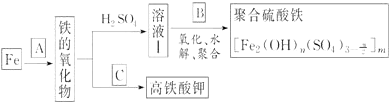
分析 如果A是水,则高温条件下,Fe和水发生反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;四氧化三铁和稀硫酸反应生成FeSO4、Fe2(SO4)3;向溶液I中加入B,若B为NaClO3与稀硫酸,发生氧化、水解、聚合反应生成[Fe2(OH)n(SO4)3n/2]m,亚铁离子被氯酸根离子氧化生成铁离子,自身被还原生成氯离子,离子方程式为6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
若C为KNO3和KOH的混合物,其与Fe2O3加热共融制得高铁酸钾(K2FeO4),反应方程式为Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;
(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平;
(3)若C为KKO3和KOH的混合物,与Fe2O3加热共融制得高铁酸钾,则缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平;
(4)①反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;
②根据反应2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-找出关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再根据c=$\frac{n}{V}$计算出铁元素含量;双氧水能氧化S2O32-.
解答 解:如果A是水,则高温条件下,Fe和水发生反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;四氧化三铁和稀硫酸反应生成FeSO4、Fe2(SO4)3;向溶液I中加入B,若B为NaClO3与稀硫酸,发生氧化、水解、聚合反应生成[Fe2(OH)n(SO4)3n/2]m,亚铁离子被氯酸根离子氧化生成铁离子,自身被还原生成氯离子,离子方程式为6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
若C为KNO3和KOH的混合物,其与Fe2O3加热共融制得高铁酸钾(K2FeO4),反应方程式为Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;
(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O,
故答案为:1;3;2;K2FeO4;3;H2O;
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉,溶液由蓝色变无色且保持半分钟不变色;
②由2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得:Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:$\frac{0.002mol×56g/mol}{0.02L}$=5.6g/L;
H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应及氧化还原反应滴定、方程式的配平等知识点,侧重考查学生分析计算能力,易错点是误差分析,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g NaCl | |
| B. | 用10mL量筒量取7.1mL稀盐酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0 kJ/mol | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知:2SO2 (g)+O2(g)?2SO3 (g);△H=-98.3 kJ/mol.将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中有物质变化也有能量变化 | |
| B. | 需要加热的化学反应不一定是吸热反应 | |
| C. | 如图所示的反应为放热反应 | |
| D. | 化学反应中的热量变化取决于反应物的能量和生成物的能量的相对高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com