
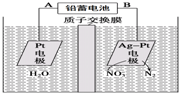
| A、铅蓄电池的A极为正极,电极材料为PbO2 |
| B、铅蓄电池工作过程中负极质量增加 |
| C、该电解池的阴极反应为:2NO3-+6H2O+10e-=N2↑+12OH- |
| D、若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为10.4g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | Na2SO4、KCl、K2CO3、NaCl |
| 第三次 | KCl、BaCl2、Na2SO4、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据化学反应中的热效应将化学反应分为放热反应和吸热反应 |
| B、根据水溶液能否导电将化合物分为电解质和非电解质 |
| C、根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物 |
| D、根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气的密度增大了 |
| B、混合体系的压强增大了 |
| C、正逆反应的速率相等,且都比原平衡状态的速率增大了 |
| D、A气体在混合气中的含量升高了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
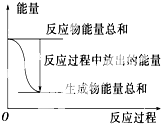
| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数是核外电子总数的1/5的原子和价电子排布式为4s24p5的两个微粒属于同种元素的原子 |
| B、在一个基态的多电子的原子中,不能有两个能量完全相同的电子 |
| C、原子核外的M层上的S能级和P能级都填满电子,而d轨道上尚未有电子的两种原子一定属于同一周期 |
| D、PCl3、BeCl2、BF3中所有原子均满足最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1份 | 第2份 | |
| 混合物质量(g) | 9.2 | 18.4 |
| 反应后固体质量(g) | 8.3 | 15.6 |
| A、本次实验至少要进行6次称重 |
| B、第1份混合物中NaOH的质量分数更大 |
| C、根据表中数据不能计算出第1份混合物中NaHCO3的质量分数 |
| D、第2份混合物中NaOH的质量分数小于0.32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com