
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
分析 (1)依据题干信息和图表中溶解度大小分析判断写出反应化学方程式;洗涤晶体的目的是洗去晶体表面的杂质;
(2)依据题干信息“Li转变为硫化锂,FeS2转变为铁”配平写出电池总反应;
(3)①依据反应物和产物结合原子守恒写出化学方程式;
②依据题干得到棕色固体为Fe2O3,铁的质量可以依据元素守恒计算得到;KClO4(s)+4Fe(s)═KCl(s)+4FeO(s);反应中KClO4和氯化钾物质的量相同,质量减少为氯化钾质量.
解答 解:(1)实验室制取高氯酸钾的步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,氯酸钾溶解度小于氯酸钠,反应得到氯酸钾,反应的化学方程式为NaClO4+KCl═KClO4↓+NaCl;经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到;洗涤的目的是洗去晶体表面的杂质,
故答案为:NaClO4+KCl═KClO4↓+NaCl;尽可能除去溶解度较大的杂质;
(2)Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时失电子的做负极发生氧化反应,得到电子的发生还原反应,电池反应为:FeS2+4Li═Fe+2Li2S,
故答案为:FeS2+4Li═Fe+2Li2S;
(3)①600℃时FeO可部分分解生成Fe3O4,依据元素守恒计算得到出生成四氧化三铁外还有铁,依据原子守恒配平可得4FeO=Fe3O4+Fe,
故答案为:4FeO=Fe3O4+Fe;
②反应过程中的反应为:KClO4(s)+4Fe(s)═KCl(s)+4FeO(s);用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,减少的固体质量是氯化钾的质量,n(KClO4)=n(KCl),在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0g棕色固体.固体是Fe2O3,n(Fe)=2n(Fe2O3),得到:m(Fe)=n(Fe)×56 g•mol-1=$\frac{6.0g}{160g/mol}$×2×56 g•mol-1=4.2g,
m(KClO4)=n(KClO4)×138.5 g•mol-1=n(KCl)×138.5 g•mol-1=$\frac{0.43g}{74.5g/mol}$×138.5 g•mol-1=0.80g,
故答案为:该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
点评 本题考查了物质制备反应的应用,铁及其化合物性质的应用,数据分析应用,溶解度变化的反应原理,原电池原理应用,混合物和反应化学方程式的计算应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
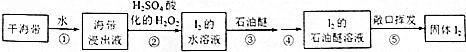
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
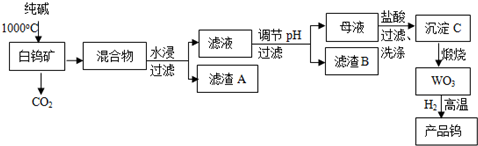
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种 | B. | 四种 | C. | 三种 | D. | 二种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羟基、羧基;
;写出A分子中官能团的名称羟基、羧基; ;
;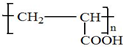 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

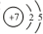 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol•L-1 | B. | 0.6mol•L-1 | C. | 0.4mol•L-1 | D. | 0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
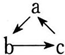 如表所列各组物质中,物质之间通过一步反应不能实现如下图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应不能实现如下图所示转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HNO3 | NO | NO2 |
| C | Al(OH)3 | NaAlO2 | Al2O3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
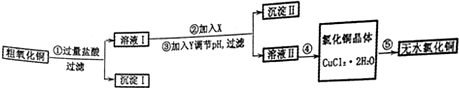
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com