
| A. | 2 CO(g)+O2(g)═2 CO2(g);△H=-566 KJ•mol-1 | |
| B. | CH4(g)+2 O2(g)═CO2(g)+2 H2O(l);△H=-890 KJ•mol-1 | |
| C. | H2 (g)+F2 (g)→2HF(g),△H=-270kJ•mol-1 | |
| D. | 250℃和1.01×105Pa时,反应4NO2(g)+O2(g)═2N2O5(g);△H=-56.76kJ/mol |
分析 燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物必须为稳定氧化物,即C转化为二氧化碳,H转化为液态水.据此分析.
解答 解:A.CO的化学计量数为2,所以△H不代表燃烧热,故A错误;
B、CH4的化学计量数为1,产物为稳定氧化物,符合燃烧热的定义,所以△H代表燃烧热,故B正确;
C.产物必须为稳定氧化物,即燃烧热的测定必须指的是1mol可燃物在氧气中的燃烧,而此反应中氢气是在氟气中燃烧的,生成的HF不是氧化物,故不能代表燃烧热,故C错误;
D.NO2的化学计量数为4,所以△H不代表燃烧热,故D错误;
故选:B.
点评 本题考查了燃烧热的概念,题目难度不大,理解此概念是应注意:可燃物的物质的量必须是1mol;生成的产物必须是稳定氧化物,例如碳形成二氧化碳、氢形成液态水.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
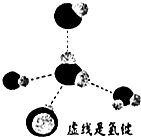 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
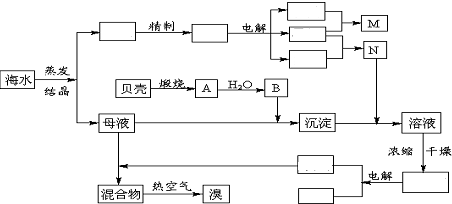
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
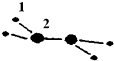 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: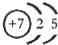 .
.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ③⑥⑤① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com