
(15分)实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:
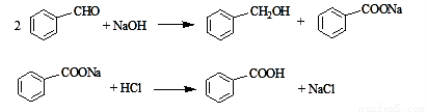
已知:①苯甲酸在水中的溶解度为:0.18 g(4 ℃)、0.34 g(25 ℃)、0.95 g(60 ℃)、6.8 g(95 ℃)。
②乙醚沸点34.6 ℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250 ℃
④苯甲醇沸点为205.3 ℃
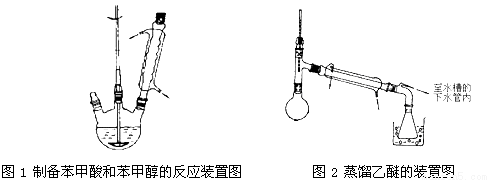
实验步骤如下:
①向图l所示装置中加入8 g氢氧化钠和30 mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205 ℃~206 ℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:选择题
用一种试剂可将三种无色液体CCl4、苯、甲苯鉴别出来,该试剂是
A.硫酸溶液 B.水 C.溴水 D.KMnO4酸性溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.12.4 g白磷中含有共价键数为0.4 NA
B.3Fe+4H2O(g)  Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
C.在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA
D.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁醋,反应温度为115-125℃,反应装置如图。下列对该实验的描述错误的是

A.为使受热均匀,可改用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、饱和碳酸钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列解释不科学的是
A.“水摘石穿”是溶解了CO2的雨水与CaCO3 长期作用生成了可溶性的Ca(HCO3)2的缘故
B.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成和从石油中提取的柴油成分完全相同的生物柴油
C.长期盛放NaOH溶液的滴瓶不易打开,主要是由于NaOH能与玻璃中的SiO2反应生成硅酸钠导致瓶塞与瓶口粘住的缘故
D.黄铜(铜锌合金)不易产生铜绿,这是因为发生电化学腐蚀时,锌被腐蚀而保护了铜。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是
A.四种元素的原子半径:rZ>rX>rY>rw
B.X、Y、Z、W形成的单质最多有6种
C.四种元素中,Z的最高价氧化物对应水化物酸性最强
D.四种元素均可与氢元素形成18电子分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:填空题
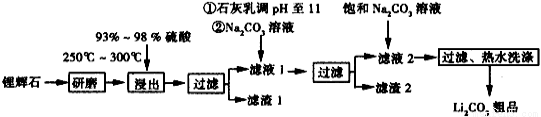
(16分)工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)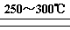 Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________。

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________。
②电解后,LiOH溶液浓度增大的原因_____,b中,生成Li2CO3反应的化学方程式是_______。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是
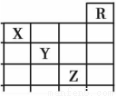
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
③Z的单质常温下是液体,一定条件下可与铁粉反应
④Z的原子序数比Y大1 9
⑤Z所在的周期中含有32种元素。
A.只有③ B.只有①④ C.只有①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:选择题
化学中有“四同”,根据“四同”的概念,下列物质间关系正确的是
A.1H2、2H2——同位素 B.HCOOCH3、CH3OCHO——同分异构体
C.S2—、S22———同素异形体 D.甲基丙烯酸、油酸——同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com