
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 7种 |
分析 由有机物Q的分子式为C5H10O2,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为2:1,由-COOH~CO2↑、2-OH~H2↑,则分子中只有1个-COOH,结合分子式可知还含烃基为-C4H9,以此来解答.
解答 解:由有机物Q的分子式为C5H10O2,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为2:1,由-COOH~CO2↑、2-OH~H2↑,则分子中只有1个-COOH,结合分子式可知还含烃基为-C4H9,-C4H9有四种结构,分别为CH3-CH2-CH2-CH2-、CH3-CH2-CH(CH3)-、(CH3)2CH-CH2-、(CH3)3C-,则Q的结构最多有4种,
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应、烃基的数目为解答的关键,侧重分析与应用能力的考查,注意丁基的判断,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
将32.5gZn投入到vmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
A.所得气体在标准状况下的体积 B.所得气体的质量
C.所得溶液的浓度 D.原硫酸的浓度
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:填空题
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_______________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L?1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .B的离子结构示意图:
.B的离子结构示意图: .D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg.
.D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
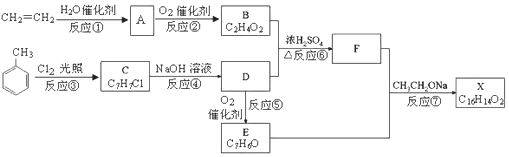
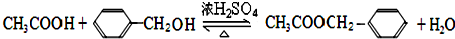 .
.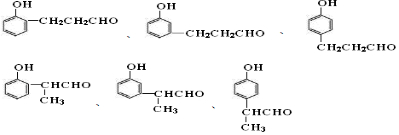 中的任意一种.
中的任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
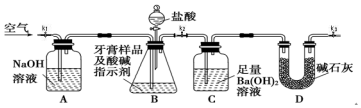
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com