
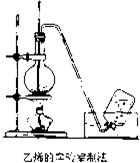
 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
| A、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
B、将容器体积变为20L,Z的平衡浓度变为原来的
| ||
| C、若压强增大1倍,则物质Y的转化率增大1倍 | ||
| D、若升高温度,X的浓度增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2- |
| B、Al3+,Mg2+ |
| C、Mg2+,AlO2- |
| D、Al3+,Mg2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应达到平衡时,c(Cu2+)=c(Mn2+) |
| B、平衡体系中加入少量CuS(s) 后,c( Mn2+) 变小 |
| C、平衡体系中加入少量Cu(NO3) 2(s) 后,c( Mn2+) 变大 |
| D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用于熔化烧碱的坩埚,可用Al2O3这种材料制成 |
| B、铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜 |
| C、氧化铝是一种难熔物质,是一种较好的耐火材料 |
| D、氧化铝能中和胃酸,可用于制胃药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com