
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
分析 (1)高猛酸碱溶液时紫红色溶液过氧化氢溶液为无色,用高猛酸碱溶液的颜色可以指示反应终点;
(2)高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色,且半分钟不褪色,滴定结束;
(3)三次消耗的高锰酸钾溶液的体积分别是:23.02mL、23.03mL、23.04mL,平均体积为23.03mL;再根据关系式5(CaO2•8H2O)~5H2O2~2KMnO4计算出过氧化钙晶体的物质的量,最后求出过氧化钙晶体的质量分数;
(4)KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,滴定消耗溶液体积增多,结果偏高;
解答 解:(1)高猛酸碱溶液时紫红色溶液过氧化氢溶液为无色,高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色,所以不需要添加指示剂,
故答案为:高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色;
(2)滴定终点观察到的现象为:当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色;
故答案为:当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色;
(3)高锰酸钾溶液消耗的体积分别是:23.02mL、23.03mL、23.04mL,平均体积为:$\frac{23.02ml+23.03ml+23.04ml}{3}$=23.03mL,
根据关系式 5(CaO2•8H2O)~5H2O2~2KMnO4
n(CaO2•8H2O)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×0.0200 mol•L-1×23.03mL×10-3L•mL-1 =1.151×10-3 mol,
CaO2•8H2O的质量分数为:$\frac{1.51×1{0}^{-3}mol×216g/mol}{0.3000g}$×100%=82.9%;
故答案为:82.9%;
(4)KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,再用此溶液滴定实验消耗标准溶液体积增多,测定结果会偏高.
故答案为:偏高;
点评 本题考查了方程式及质量分数的计算,主要是滴定实验步骤、终点判断和计算问题,难度中等,注意关系式的应用.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
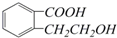 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: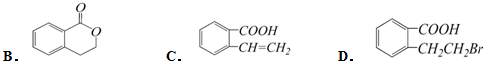
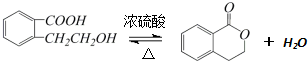 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2中 | B. | SO3、SO2中 | C. | SO3中 | D. | SO3、SO2、O2中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 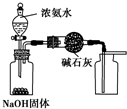 用图所示装置制取干燥纯净的氨气 | |
| B. | 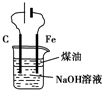 用图所示装置制备并观察氢氧化亚铁的颜色 | |
| C. | 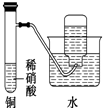 为制备并收集少量NO2气体 | |
| D. |  量取0.10 mol•L-1KOH溶液20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子半径为d>c>b>a | |
| B. | b,d元素形成的最高价氧化物对应的水化物的酸性b>d | |
| C. | c与其它3种元素均能形成离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可能为酸性、也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
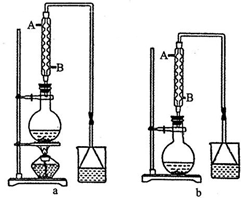 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com