
常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,滴定曲线如下图所示,下列说法正确的是
溶液,滴定曲线如下图所示,下列说法正确的是
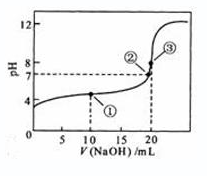
A. ![]()
B. 滴定过程中,不可能存在:![]()
C. 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定
D. 若将盐酸换作同浓度的醋酸,则滴定到![]() 时,
时,![]()
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | 2- 6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
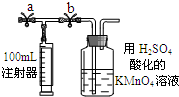 常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一.我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3.某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):
常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一.我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3.某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):查看答案和解析>>
科目:高中化学 来源: 题型:
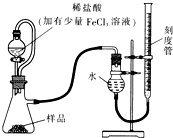 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com