
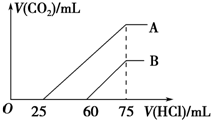
 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
分析 ①当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
②逐滴加入0.1mol•L-1 的盐酸,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
③先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
解答 解:A.由CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,则在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3,故A正确;
B.当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH 和Na2CO3,由HCO3-+H+=H2O+CO2↑可知,与盐酸反应产生CO2的最大体积是0.015L×0.1mol/L×22.4L/mol=0.336L,故B错误;
C.先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为cmol/L,加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=7.5×10-3mol,c(NaOH)=$\frac{7.5×1{0}^{-3}mol}{0.05L}$=0.15mol/L,故C错误;
D.由图可知,对应B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积为60mL,远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3,故D正确;
故选AD.
点评 本题考查离子反应及化学反应的计算,为高频考点,把握图象与反应的对应关系及溶质的判断为解答的关键,注意分析与计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该晶体中一定含有SCN- | B. | Fe3+的氧化性比I2的氧化性强 | ||
| C. | Fe3+被I-还原 | D. | Fe2+是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2+2NaOH═NaNO3+NaNO2+H2O | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 | |
| C. | CaH2+2H2O═Ca(OH)2+2H2↑ | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

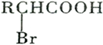
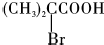 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应;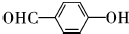 ;
;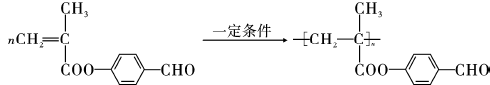 ;
;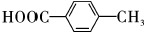 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的体积分数变大 | D. | a+b>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔效应可以区别溶液和胶体 | |
| B. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| C. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 | |
| D. | 向品红溶液中通入SO2气体红色褪去,再加热恢复红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com