
分析 Ⅰ.(1)反应只消耗了铜和水,说明铜在阳极放电,所以阳极材料是铜;
②阴极发生还原反应,阴极的电极反应式是2H2O+2e-=H2↑+2OH-;电解总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cu2O;
(2)①根据反应物N2H4和Cu(OH)2,生成物是Cu20、H2O和N2,可得化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu2O+6H2O;
②亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体,反应方程式为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,随反应的不断进行溶液的PH不断下降,所以加入氢氧化钠是调节溶液的PH的;
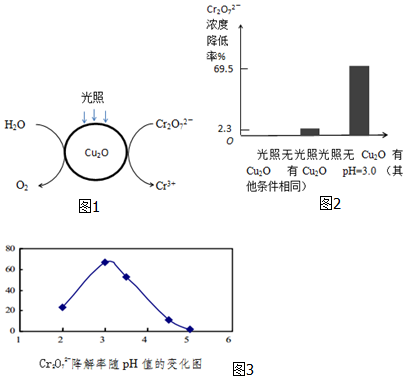
Ⅱ.(1)负极是水中-2价的氧失电子,而正极Cr2O72-转化Cr3+,由此标出电子的转移方向,和书写电极反应式;
(2)根据Cr2O72-的物质的量浓度,结合关系式3Cu2O-Cr2O72-,求Cu2O的物质的量与已知量相比较;
(3)①由图可知:pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+;
②pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面;
解答 解:Ⅰ、(1)①反应只消耗了铜和水,说明铜在阳极放电,所以阳极材料是铜,故答案为:Cu;
②反阴极发生还原反应,阴极的电极反应式是2H2O+2e-=H2↑+2OH-;电解总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cu2O,故答案为:2H2O+2e-=H2↑+2OH-;2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cu2O;
(2)①根据反应物N2H4和Cu(OH)2,生成物是Cu20、H2O和N2,可得化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu2O+6H2O,故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu2O+6H2O;
②亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体,反应方程式为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,随反应的不断进行溶液的PH不断下降,所以加入氢氧化钠是调节溶液的PH的,故答案为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱;
Ⅱ.(1)负极是水中-2价的氧失电子,而正极Cr2O72-转化Cr3+,电子的转移方向为: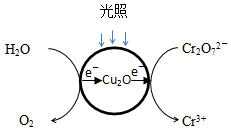 ,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为:
,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为: ;Cr2O72-+14H++6e-=2Cr3++7H2O;
;Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)若发生氧化还原反应,则存在比例:3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在,故答案为:Cu2O作光催化剂;3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①由图可知:pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,故答案为:pH=3;pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;
②pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面,故答案为:pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行.
点评 本题综合考查环境保护,为高频考点,题目涉及化学平衡原理、氧化还原反应、离子方程式的书写和有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. | 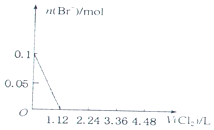 | D. | 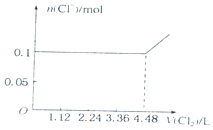 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
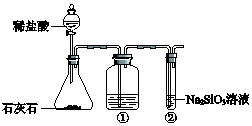 C、Si是构成无机非金属材料的重要元素.
C、Si是构成无机非金属材料的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 |
 取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 | 放置一段时间后,生铁片上出现如图所示“斑痕”.其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈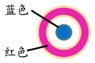 |
| A. | 生铁片发生吸氧腐蚀 | |
| B. | 中心区:Fe-2e-═Fe2+ | |
| C. | 边缘处:O2+2H2O+4e-═4OH- | |
| D. | 交界处:4Fe2++O2+10H2O═4 Fe(OH)3+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的沸点高于丙烷 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | CH2=C(CH3)2的名称是2-甲基-2-丙烯 | |
| D. | 对二甲苯的核磁共振氢谱有4个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量为17g•mol-1 | |
| B. | 0.5mol H2所占体积约为11.2L | |
| C. | 等质量的金刚石和晶体硅所含原子个数之比为7:3 | |
| D. | 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑦ | D. | ①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 mL水中含有的分子数目约为1.24NA | |
| B. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| C. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| D. | 常温常压下的33.6L氯气与56g铁充分反应,转移电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com