
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
D. 化学反应中每生成1molO2,转移的电子数为4NA
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】已知标准状况下,m1 g气体G1与m2 g气体G2的分子数相同,则:
(1)同温同压下G1和G2的密度比为___________(用m1、m2表示);
(2)同温同质量的G1和G2的分子数比为____________(用m1、m2表示);
(3)同温同压下同体积G1和G2的质量比为____________(用m1、m2表示);
(4)两密闭容器,若温度、密度相同(m1>m2),则其压强(p)G1________G2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是生物体内四种有机物的组成与功能关系图,有关叙述不正确的是 ( )
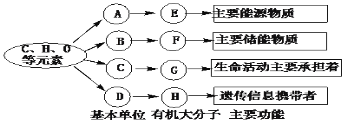
A. 玉米种子细胞中,物质A和E分别代表葡萄糖和纤维素
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 在人体细胞中物质C约有20种
D. 不同的H在结构上的区别主要是碱基的排列顺序不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
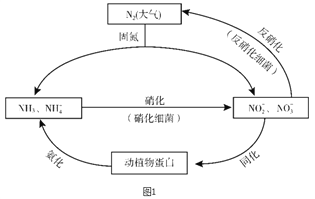
(1)结合上图判断下列说法正确的是________(填字母序号)。
A. 固氮过程中,N2只做氧化剂
B. 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C. 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D. 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的反应的化学方程式为_______。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:5CH3OH + 6NO3- ![]() N2↑ + 4HCO3- +□______+□
N2↑ + 4HCO3- +□______+□
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:_______。
共价键 | N≡N | H—H | N—H |
断开1mol共价键所需能量(kJ) | 946 | 436 | 391 |
(5)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图2和图3所示。
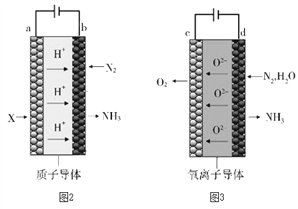
①图2中,a电极上通入的X为_______。
②图3中,d电极上的电极反应式为_______。
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均
HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均![]() 为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是

A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应的CO的转化率与CH3OH的转化率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
B. ![]() 的系统命名法为2,5-二甲基-4-乙基己烷
的系统命名法为2,5-二甲基-4-乙基己烷
C. 总质量一定时,乙酸和甲醛无论以何种比例混合,完全燃烧消耗氧气的量相等
D. 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5 mol CO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)100 mL气体A2跟50 mL气体B2恰好完全反应生成100 mL气体C(体积均在相同条件下测定)则C的化学式为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制460mL0.1mol/LNaOH溶液,回答下列问题:
(1)完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、量筒、_____、_____等。
(2)应用托盘天平称取NaOH固体的质量为_________。
(3)下面操作造成所配NaOH溶液浓度偏高的是_________________
A .将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
B .摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C .定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未干燥处理
E. NaOH固体放在烧杯中称量时间过长
(4)取上述体积均为150mL的 A、B 两份NaOH 溶液,分别通入一定量的 CO2 后,再向所得溶液中滴加一定物质的量浓度的盐酸 , 产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
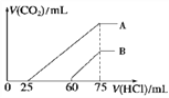
①B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
②A 曲线表明,盐酸的浓度为______mol/L;通入的CO2在标准状况下的体积为______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com