
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
科目:高中化学 来源:不详 题型:单选题

| A.上述三种溶液中:c( OH-)大小:③ > ② > ① |
| B.物质酸性的比较:CH3COOH > HF > H2CO3 |
| C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- ) |
| D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a的数值一定大于9 |
| B.I为氢氧化钠溶液稀释时溶液的pH变化曲线 |
| C.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水) |
| D.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(HF)>c(OH-) | D.c(HF)>c(F-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目增加 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,但电离平衡常数Ka不变 |
| D.再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
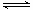 NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 |
| D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com