
| A、1mol/L的NaCl溶液是指此溶液中含有1mol NaCl |
| B、从1 L 0.5 mol/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1 mol/L |
| C、常温下,1molCl2的体积约为22.4L |
| D、l mol/L的CaCl2溶液中,Cl-的物质的量浓度为2 mol/L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、铜锌原电池中铜是正极 |
| B、用电解法精炼铜时粗铜作阴极 |
| C、在电镀时,镀件上镀铜可用铜作阳极 |
| D、电解饱和食盐水制取氯气时,用铜片作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳离子一定是金属离子,阴离子一定只含非金属元素 |
| B、某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物 |
| C、阴、阳离子相互作用后不一定形成离子化合物 |
| D、离子化合物一定都溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH2-所含的质子数为9NA个,电子数为10NA个 |
| B、NA个微粒就是6.02×1023个微粒 |
| C、0.1mol硫酸分子包含的原子总数为0.7NA个 |
| D、28g一氧化碳所含电子数是28NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S |
| B、CaCO3 |
| C、HCl |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
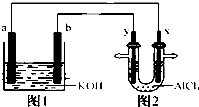 已知有如图装置,a为Mg、b为Al,图2电极材料均为石墨,下列说法正确的是( )
已知有如图装置,a为Mg、b为Al,图2电极材料均为石墨,下列说法正确的是( )| A、b和y表面均冒氢气,b对应电极反应式:6H2O+6e-=3H2↑+6OH- |
| B、装置图1工作时电解质溶液PH将增大 |
| C、将装置图1电解质溶液改成硝酸钾和硫酸氢钠混合溶液则装置图1中产生无色气体后在液面上方气体变红棕色 |
| D、当图2装置中产生0.1mol白色沉淀时x,y处共产生气体6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 7 |
A、氧化性Cr2O
| ||
B、Cr2O
| ||
| C、若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O70.5mol | ||
| D、每反应1molK2Cr2O7,转移电子3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示可逆反应:N2(g)+3H2(g)═2NH3(g)达到化学平衡状态时外界条件影响导致平衡移动的曲线,根据判断影响平衡移动的因素是( )
如图表示可逆反应:N2(g)+3H2(g)═2NH3(g)达到化学平衡状态时外界条件影响导致平衡移动的曲线,根据判断影响平衡移动的因素是( )| A、升高温度,同时加压 |
| B、减小压强,同时降温 |
| C、增大反应物的浓度,使用催化剂 |
| D、增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com