
| A. | Cl- | B. | NH4+ | C. | H+ | D. | OH- |
科目:高中化学 来源: 题型:选择题
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点 | 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是分子晶体 | |
| B. | 表中只有BCl3和干冰是分子晶体 | |
| C. | 离子晶体熔化时破坏离子键 | |
| D. | 分子晶体熔化时不破坏共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
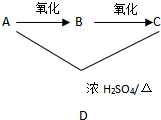 A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示:
A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H3O+ 所含质子数为10NA | |
| B. | 40克氖气所含分子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下32 g O2所含原子数不是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 某澄清溶液中:HCO3-、Na+、Al3+、Br- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用Ca(OH)2和NH4Cl制取NH3 | B. | 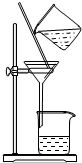 从碘水中提取碘单质 | ||
| C. | 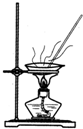 从食盐水中获取氯化钠 | D. | 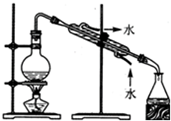 用自来水制取蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com