
分析 (1)加硫酸可除杂,反应生成水、二氧化碳;
(2)加氯化钡可除杂,硫酸根离子与钡离子结合生成沉淀;
(3)加Fe可除杂,Fe与铜离子反应生成亚铁离子和Cu.
解答 解:(1)加硫酸可除杂,反应生成水、二氧化碳,离子反应为2H++CO32-═H2O+CO2↑,故答案为:硫酸;2H++CO32-═H2O+CO2↑;
(2)加氯化钡可除杂,硫酸根离子与钡离子结合生成沉淀,离子反应为Ba2++SO42-═BaSO4↓,故答案为:氯化钡;Ba2++SO42-═BaSO4↓;
(3)加Fe可除杂,Fe与铜离子反应生成亚铁离子和Cu,离子反应为Fe+Cu2+═Fe2++Cu,故答案为:Fe;Fe+Cu2+═Fe2++Cu.
点评 本题考查离子反应方程式的书写及除杂,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的腐蚀一定伴有电流产生 | |
| B. | Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀 | |
| C. | 发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀 | |
| D. | 发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
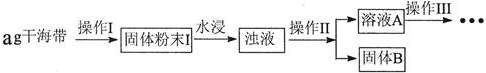
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 |  |
| ② | 往试管Ⅰ中加入FeCl2溶液后,加入2滴KSCN溶液并振荡 | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是氨气发生装置 | B. | ②是氨气吸收装置 | ||
| C. | ③是氨气发生装置 | D. | ④是氨气收 集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物的水化物具有弱酸性 | |
| B. | 阳离子的氧化性:Y>W | |
| C. | 原子半径:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、4、4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com