
| A. | 500 mL 0.1 mol/L盐酸中,含有HCl分子数目为0.05NA | |
| B. | 0℃、1个标准状况下,22.4LNO和22.4LO2混合后所得气体中分子总数为1.5NA | |
| C. | 常温下.0.5 moll•L-l Fe3(SO4)2溶液中含 Fe3+数目为1NA | |
| D. | 在标准状况下,22.4 LCH4与18 g H2O所含有的质子数、电子数均为10 NA |
分析 A.盐酸中不存在氯化氢分子;
B.一氧化氮与氧气反应生成二氧化氮,二氧化氮与四氧化二氮之间存在转化平衡,所以反应后的物质中含有的分子数减小;
C.溶液体积未知;
D.分别求出两者的物质的量,然后根据甲烷和水均为10电子微粒来分析.
解答 解:A.盐酸中不存在氯化氢分子,故A错误;
B.据2NO+O2═2NO2可知:标准状况下,22.4 L NO即1molNO 和22.4 L O2 即1mol氧气混合后所得气体的物质的量为1.5mol,但由于NO2气体中存在平衡:2NO2?N2O4,导致分子总数小于1.5 NA,故B错误;
C.溶液体积未知,无法计算三价铁离子数目,故C错误;
D.标况下22.4L甲烷和18g水的物质的量均为1mol,而甲烷和水均为10电子微粒,故1mol两者中均含10mol电子即10NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大,注意氯化氢为强电解质,溶于水完全电离.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用热的浓盐酸除去试管内壁的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
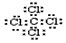 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 横线中的物质是Cu2S | B. | CuFeS2仅作还原剂 | ||
| C. | SO2是还原产物,不是氧化产物 | D. | FeS是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和硝酸银用棕色试剂瓶保存 | |
| B. | 常温下铁和铂都不溶于浓硝酸 | |
| C. | 亚硫酸盐和硫酸亚铁固体长期暴露在空气中变质 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | NH3、CO、CS2都是极性分子 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:N>F>O | |
| D. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com