
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是(双选)( )。
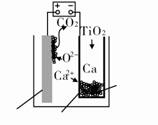
A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接PbO2电极
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
工业合成氨的反应是在500℃左右进行的,这主要是因为( )
A.500℃时此反应速率最快
B.500℃时NH3的平衡浓度最大
C.500℃时N2的转化率最高
D.500℃时该反应的催化剂活性最大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,在溶液里能大量共存,且溶液为无色透明的是( )
A.NH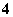 、NO
、NO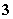 、Al3+、Cl-
、Al3+、Cl-
B.Na+、SiO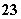 、NO
、NO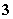 、Fe3+
、Fe3+
C.Na+、MnO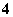 、K+、SO
、K+、SO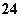
D.Na+、HCO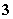 、SO
、SO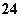 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO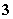
B.水电离出的[H+]=1×10-3 mol·L-1的水溶液中:Na+、CO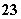 、Cl-、K+
、Cl-、K+
C.pH=1的水溶液中:NH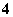 、Cl-、Mg2+、SO
、Cl-、Mg2+、SO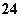
D.Al3+、HCO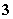 、I-、Ca2+
、I-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告请填写有关空白):
一)测定目的:测定工厂工业废水中的游离态氯的含量
二)测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6
三)实验用品及试剂:
1)仪器和用品自选,略)
2)试剂:指示剂________填名称),KI溶液,浓度为0.010 mol/L 的标准Na2S2O3溶液,蒸馏水等。
四)实验过程:
1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液足量),滴入指示剂2~3滴。
2)取碱式滴定管经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mL/L Na2S2O3溶液待用。
3)将锥形瓶置于滴定管下方进行滴定,眼睛注视______直至滴定终点,滴定至终点的现象是__________________________。
五)数据记录与处理:请在下面表格中的有括号的横线上填上必要的物理量,不必填数据)
| 滴定 次数 | ______) | ____________) | |||
| ______) | ______) | ______) | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 |
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为________,从实验过程分析,此浓度比实际浓度________填“偏大”、“偏小”或“相等”),造成误差的原因是
________________________________________________________若认为没有误差,该问可不答)。
六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是________填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡,下列叙述正确的是
)。
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1盐酸,溶液中cH+)减小
D.加入少量CH3COONa固体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强、正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是K=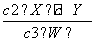
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是( )
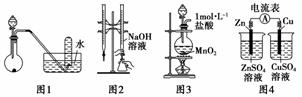
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com