
| A. | 常温常压下,33.6L CH3Cl中含有H原子数小于4.5NA | |
| B. | 1mol 18O2 中含有的质子数为20NA | |
| C. | 一定条件下,26g乙炔和苯混合气体含有C原子数为2NA | |
| D. | 电解精炼铜时,电路中转移电子数为2NA时,理论上阴极的质量增加64g |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.18O2 分子中含有16个质子;
C.乙烯和苯的最简式为CH,根据最简式计算;
D.电解精炼铜时,阴极得到的是金属铜,根据电子守恒计算出生成铜的物质的量及质量.
解答 解:A.常温常压下气体摩尔体积大于22.4L/mol,33.6L CH3Cl的物质的量小于$\frac{33.6L}{22.4L/mol}$=1.5mol,含有H的物质的量小于4.5mol,含有原子数小于4.5NA,故A正确;
B.1mol 18O2 中含有16mol质子,含有质子数为16NA,故B错误;
C.26g乙炔和苯的混合气体中含有26g最简式CH,含有CH的物质的量为:$\frac{26g}{13g/mol}$=2mol,含有C原子数为2NA,故C正确;
D.2NA个电子的物质的量为2mol,转移2mol电子,阴极得到1mol铜,阴极质量增加了64g,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,A为易错点,注意气体摩尔体积的影响因素.


科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有②③ | C. | 只有①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 .
.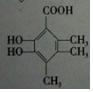 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | M-空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将稀盐酸滴入加有酚酞的Na2SiO3溶液中,边加边震荡, | 红色变浅并接近消失 | 有硅酸胶体生成 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液中滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>ka2 | H2CO3一级电离常数产生的H+对二级电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 | |
| 将苯滴入溴水中,振荡,静置 | 溴水层褪色 | 溴和苯发生加成反应 | |
| 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 | |
| 相同的铝片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A. | N电极上每消耗22.4L气体(标准状况)时,则有4molH+通过质子交换膜从负极区移向正极区 | |
| B. | 若装置乙所需的电能来自装置甲,则b极应与X 极连接 | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| D. | 由装置乙制得的家用消毒液的主要成分是NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .对于人的身体来说,乳酸是疲劳物质之一,是身体在保持体温和肌体运动而产生热量过程中产生的废弃物.试回答:
.对于人的身体来说,乳酸是疲劳物质之一,是身体在保持体温和肌体运动而产生热量过程中产生的废弃物.试回答: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com