
【题目】某学习小组用Na2O2设计装置验证某些物质的性质。甲组:在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
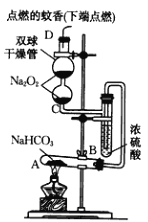
(1)在A试管内发生反应的化学方程式是__。
(2)B装置的作用是__。
(3)在双球干燥管内发生反应的化学方程式__,当有1molNa2O2发生反应,转移电子数目为__;双球干燥管内观察到的实验现象是__。
(4)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是__。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 吸收气体中的水蒸气(或干燥CO2) 2Na2O2+2CO2=2Na2CO3+O2 NA(或6.02×1023) 淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈 点燃的蚊香逐渐熄灭
Na2CO3+H2O+CO2↑ 吸收气体中的水蒸气(或干燥CO2) 2Na2O2+2CO2=2Na2CO3+O2 NA(或6.02×1023) 淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈 点燃的蚊香逐渐熄灭
【解析】
(1)在A试管内碳酸氢钠加热分解为碳酸钠、水和二氧化碳;发生反应的化学方程式是2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(2)浓硫酸具有吸水性,B装置的作用是吸收气体中的水蒸气。
(3)在双球干燥管内过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应方程式是2Na2O2+2CO2=2Na2CO3+O2;反应中过氧化钠既是氧化剂又是还原剂,过氧化钠中氧元素化合价由-1升高为0、由-1降低为-2,当有1molNa2O2发生反应,转移电子数目为NA;氧气能助燃,双球干燥管内观察到的实验现象是淡黄色的Na2O2逐渐转变为白色粉末碳酸钠,点燃的蚊香燃烧更加剧烈。
(4)Na2O与二氧化碳反应不能放出氧气,若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是点燃的蚊香逐渐熄灭。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】可用以下方法处理尾气中的SO2。
方法一:活性炭还原法:
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)+Q
S2(g)+2CO2(g)+Q
反应进行到不同时间测得各物质的浓度如图:
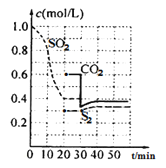
(1)第一次达到平衡的时间是第___min;0~20min化学反应速率表示v(SO2)=___。
(2)30min时平衡发生移动的条件是___。
(3)40min时,平衡常数的计算式为___。(指代入具体数值的算式)
方法二:亚硫酸钠吸收法
(4)Na2SO3溶液吸收SO2的离子方程式为___;
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
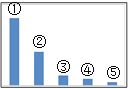
其中③是___。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.水电离出c(OH一)=1×l0-8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: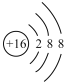
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中,反应2HI(g)![]() H2(g)+I2(g,紫色),下列不能说明已达平衡状态的是( )
H2(g)+I2(g,紫色),下列不能说明已达平衡状态的是( )
A.各物质的浓度不再变化B.混合体颜色不再变化
C.HI、H2、I2的物质的量浓度之比为2:1:1D.HI的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( )
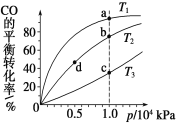
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)>M(c) M(b)>M(d)
D.平衡常数:K(a)<K(c) K(b)=K(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体准晶体和非晶体。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为___。
(3)NH4F(氟化铵)可用于玻璃的蚀刻、防腐剂、消毒剂。氟化铵溶液中存在__(填字母)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____kJmol-1。
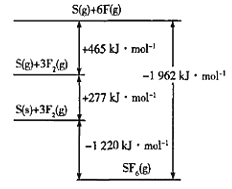
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,回答下列问题
I.氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应均为2H2+O2 = 2H2O。
(1)工作时,电解质溶液中的阴离子移向_______极(填“正”或“负”)。
(2)酸式氢氧燃料电池的电解质溶液是稀硫酸,其正极的电极反应为________。
(3)碱式氢氧燃料电池的电解质溶液是KOH溶液,其负极的电极反应为_______。
II.通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,O2-可在固体电解质中自由移动。
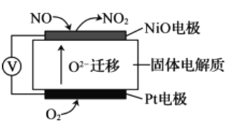
(1)NiO电极上发生的是________反应(填“氧化”或“还原”)。
(2)外电路中,电子是从_________电极流出(填“NiO”或“Pt”)。
(3)Pt电极的电极反应为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com