
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:分析 A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,则B是C元素;
D的原子核外有8个运动状态不同的电子,则D是O元素,C原子序数大于B而小于D,则C是N元素;
E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子,E原子序数大于D,则E为Fe元素,F为Cu元素,
(1)B、C、D分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)A.沸点:原子晶体>分子晶体;
B.同一周期元素,元素电负性随着原子序数增大而增大;
C.等电子体结构相似但性质不同;
D.氢化物的稳定性与非金属元素的非金属性强弱有关,与氢键无关;
(3)离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
(4)晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$,该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{12}{{N}_{A}}×8}{ρ}$cm3,该晶胞体长=$\sqrt{3}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm.
解答 解:A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,则B是C元素;
D的原子核外有8个运动状态不同的电子,则D是O元素,C原子序数大于B而小于D,则C是N元素;
E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子,E原子序数大于D,则E为Fe元素,F为Cu元素,
(1)B、C、D分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以B、C、D第一电离能由低到高顺序是C<O<N,
故答案为:C<O<N;
(2)A.沸点:原子晶体>分子晶体,二氧化硅是原子晶体、二氧化碳是分子晶体,所以沸点SiO2>CO2
,故A错误;
B.同一周期元素,元素电负性随着原子序数增大而增大,所以电负性顺序:C<N<O<F
,故B正确;
C.等电子体结构相似但性质不同,二者原子个数相等、价电子数相等,所以是等电子体,但二者不是同一物质,化学性质不同,故C错误;
D.氢化物的稳定性与非金属元素的非金属性强弱有关,与氢键无关,非金属性O>S,所以稳定性:H2O>H2S
,故D错误;
故选ACD;
(3)Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小,FeO的熔点比Fe2O3低,
故答案为:低;Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3低;
(4)该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{12}{{N}_{A}}×8}{ρ}$cm3,该晶胞体长=$\sqrt{3}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$=$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、电负性大小比较、第一电离能大小比较、等电子体等知识点,为高频考点,注意等电子体物理性质相似但化学性质不同,难点是晶胞计算,注意该晶体中两个距离最近原子之间距离与晶胞体长关系,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 63.00 | B. | 63.60 | C. | 64.00 | D. | 65.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )| A. | 苯和氢气 | B. | 稀硫酸与一氧化碳 | ||
| C. | 饱和食盐水与氯气 | D. | 浓溴水和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳酸二甲酯资料 | |||||
| 简称 | 键线式 | 熔点 | 沸点 | 化学性质 | 用途 |
| DMC | 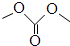 | 4℃ | 90.1℃ | 非常活泼、很易水解 毒性很低 | 有机合成中间体 |
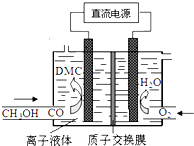 则下列说法正确的是( )
则下列说法正确的是( )| A. | 通O2区是阴极区,质子通过交换膜从阴极区移向阳极区 | |
| B. | 阳极反应:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 离子液体必须是水溶液,目的是传递电荷 | |
| D. | 电合成DMC的总反应方程式:CO+2CH3OH═(CH3O)2CO+H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com