
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)
A. 28g氮气所含有的原子数目为NA
B. 在常温常压下,32克氧气含有的分子数为NA
C. 标准状况下,22.4L水中含有NA个水分子
D. 标准状况下,22.4L氧气和氢气混合物所含的分子数为2NA
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】闽东盛产牡蛎。明《弘治温州府志》指出:“蜃灰,以牡蝠壳烧灰为上”。将“蜃灰”溶于水可制成碱液,“蜃灰”的主要成分是( )
A. CaO B. CaCO3 C. SiO2 D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=1.0×10-12,Ksp(AgI)=8.7×10-17;
(1)若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________。(填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188g的AgBr(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________。
(3)①由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______(填“能”或“否”),简述理由:_____________________________________________________________。
②若某KCl溶液的浓度为1.0×10-2mol·L-1,将等体积的该KCl溶液与AgNO3溶液混合,则生成沉淀所需AgNO3溶液的最小浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据阿伏加德罗定律的相关内容,下列说法错误的是( )
A.温度相同、体积相同的 O2(g)和 N2(g)分子数相同
B.等温等压下,SO2气体与 CO2气体的密度之比等于 16:11
C.温度和容积相同的两气罐中分别盛有 5 mol O2(g)和 2 molN2 (g),两容积中的压强之比等于 5:2
D.等温等压条件下,5 molO2(g)和 2 molH2(g)的体积之比等于 5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况).(已知MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是

A.X、Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H>0
C.反应温度控制在240℃~260℃之间
D.选择合适催化剂,可以提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)H2SO4与HNO3的摩尔质量分别为、 , 9.8g H2SO4与g HNO3所含的分子数相同,它们所含氢原子数之比是 .
(2)一定量H2SO4与HNO3中的氧原子数相等,则溶液中H2SO4与HNO3的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
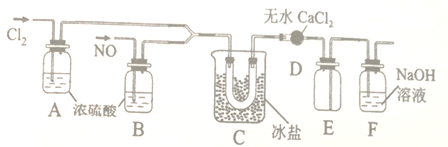
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com