
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
| 6.72L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |
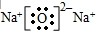 ,故答案为:
,故答案为: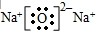 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成一定体积的溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成一定体积的溶液,请计算 查看答案和解析>>
科目:高中化学 来源: 题型:
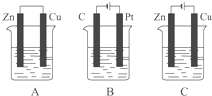 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.按要求写出电极反应式.A池中铜电极上的电极反应式为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/cm3 质量分数:36.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18gH2O含电子数为10NA |
| B、标准状况下,22.4L氦气含有的原子数为NA |
| C、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
| D、48gO2和 O3的混合物所含的氧原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com