
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
(1)硝酸;氨水 (2)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+。
(3)Ca2++CO32-=CaCO3↓ (4)CaO2+2H2O=Ca(OH)2+O2↑
(5)45% (6)8.0;100ml容量瓶、玻璃棒
解析试题分析:(1)已知滤液B的主要成份是硝酸铵,则根据原子守恒可知酸X为硝酸。溶液中含有铁离子,要转化为氢氧化铁沉淀,则需要加入碱液。根据滤液B是硝酸铵可知,A应该是氨水。
(2)三价铁离子遇到硫氰酸根离子会呈现红色,方程式为Fe3++3SCN-=Fe(SCN)3,据此可以检验铁离子的存在。即取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+。
(3)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应的离子方程式为Ca2++CO32-=CaCO3↓。
(4)过氧化钙的性质类似于过氧化钠,与水反应的化学方程式为CaO2+2H2O=Ca(OH)2+O2↑。
(5)氧化钙与水反应得不到气体,只有过氧化钙与水反应生成氧气,其中氧气的物质的量=0.112L÷22.4L/mol=0.005mol。则根据方程式CaO2+2H2O=Ca(OH)2+O2↑可知消耗过氧化钙的物质的量是0.005mol,质量=0.005mol×72g/mol=0.36g,所以该样品中CaO2含量为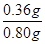 ×100%=45%。
×100%=45%。
(6)在稀释过程中溶质是不变的,则要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为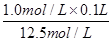 =0.008L=8.0ml。配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有100ml容量瓶、玻璃棒。
=0.008L=8.0ml。配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有100ml容量瓶、玻璃棒。
考点:考查物质制备流程的有关判断、铁离子检验、纯度测定计算、一定物质的量浓度溶液的配制


科目:高中化学 来源: 题型:单选题
下列实验操作与实验目的或结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶质中先滴加稀硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| B | 将混合气通过饱和的Na2CO3溶液 | 除去CO2中混有的HCl |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 将苯滴入溴水中,振荡,静置,溴水层褪色 | 溴或苯发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列实验的叙述中正确的是
| A.溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B.在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C.实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D.用电石和水可制得纯净的乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(一)实验室用Na2CO3·10H2O配制500ml 0.10mol·L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
| 应量取Na2CO3·10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| | | |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室欲配制100 mL、1mol/L的NaCl溶液,请回答:
(1)不需要使用的仪器是 。
A、烧杯B、500 mL容量瓶C、量筒 D、胶头滴管 E、玻璃棒 F、100 mL容量瓶
(2)配制时用托盘天平应称取NaCl g。
(3)配制溶液的操作顺序是(用字母表示) 。
A、称量 B、洗涤 C、定容 D、溶解 E、摇匀 F、转移
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I. 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50 g/100mL,而配制醋国家标准仅为1.50 g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为_______g/100mL,属于____________醋(填“酿造”或“配制”)。(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_______________________________。
II. 下图是重庆一中化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配100mL1mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有 ;
(2)经计算,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol/L,引起误差的原因可能是 。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| C.转移溶液后,未洗涤烧杯和玻璃棒 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
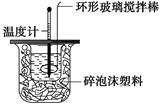
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
 温度 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
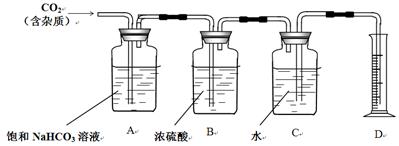
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2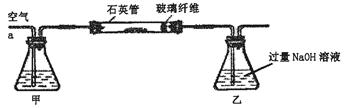
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com