
右表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是
X | Y | ||
Z | W |
A.原子半径:Z>X>Y
B.若Z的最高价氧化物遇Y的氢化物溶液混合后有气体放出,则W的氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见液态化合物,则W单质的溶液有漂白性
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
在实验室中常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为: C2O42—+MnO4—+H+—→Mn2++CO2↑+H2O。下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.用酸式滴定管量取草酸钠溶液
C.该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月阶段测化学试卷(解析版) 题型:实验题
(14分)氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。
实验室制备装置和工业制备流程图如下:
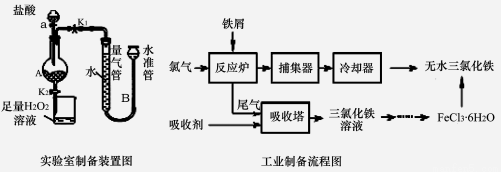
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对式量:Cl-35.5、Fe-56)为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是: ;
②样品中氯化铁的质量分数 ;
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br—还原性强于Cl— |
D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述
不正确的是________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2——K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是
A.Na+、Ba2+、NO3―、CO32―
B.Fe2+、Na+、SO42―、NO3―
C.Mg2+、NH4+、SO42-、Cl-
D.Ba2+、K+、Cl-、NO3―
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:实验题
莫尔盐[(NH4)2Fe(SO4)2•6H2O]在定量分析中常用作标定高锰酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是___ _,由此可知莫尔盐晶体分解的产物中有 。装置B的主要作用是 。

(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3 (g)、SO2 (g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
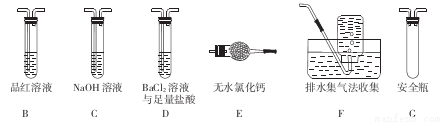
①乙组同学的实验中,装置依次连接的合理顺序为A、___ _。
②装置D中足量盐酸的作用是 ;含有SO3的实验现象是 ;含有SO2的实验现象是_______________________
(3)设计实验证明:
①莫尔盐是否已氧化变质。 。
②莫尔盐可用于标定高锰酸钾溶液的浓度(并写出相应的离子方程式)。 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中测试化学试卷(解析版) 题型:选择题
下列有关物质用途的说法正确的是
A.明矾可用作净水剂 B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多 D.铝制容器可长期存放酸性食物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第一次月考化学试卷(解析版) 题型:选择题
某密闭容器中发生如下反应:X(g)+Y(g)  2Z(g) ΔH<0。如右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) ΔH<0。如右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
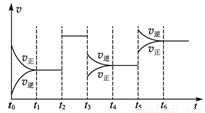
A.t2时一定加入了催化剂 B.t3时减小了压强
C.t5时一定升高了温度 D.t4~t5时间内转化率最低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com