
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4 B.碱性:NaOH>KOH
C.非金属性: P>S D.气态氢化物稳定性: HCl>H2S
科目:高中化学 来源: 题型:
下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
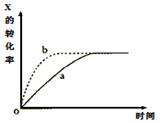
A.减小体积 B.加大X的投入量
C.减压 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(Ⅰ)I2(g) + H2(g)  2 HI(g) ΔH=-9.48 kJ/mol
2 HI(g) ΔH=-9.48 kJ/mol
(Ⅱ)I2(s) + H2(g)  2 HI(g) ΔH=+26.48 kJ/mol
2 HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①该反应的化学平衡常数表达式是K= 。
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T / K | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
其中,K1 K2(填“>”、“=”或“<”)。
③ 下列措施可以提高H2的转化率的是(填选项序号)____________________。
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
④ 一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,
,
求N2的转化率α1。(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2 α1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
① NH3被氧气催化氧化生成NO的反应的化学方程式是_________________。
② 在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
 |
a.在t1 ~ t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3 ~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g)=2H2O(g) ΔH=— 483.6 kJ/mol
N2(g) + 2O2(g)=2NO2(g) ΔH=+ 67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液中含有NO3-、SO32-、Cl-和NH4+,若向其中加入足量的盐酸,溶液里上述四种离子的浓度基本保持不变的是( )
A.NO3- B.SO32- C.Cl- D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)元素A是第三周期ⅦA族元素,A元素与另两种非金属元素可组成离子化合物甲。写出甲的化学式________。
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置____________________ 。
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是________ (用离子符号表示),元素D的原子序数比元素C小8,写出元素D的单质在CO2中燃烧的化学方程式________ 。
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的的离子方程式__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原电池的叙述中正确的是( )
A.把电能转变为化学能的装置
B.活泼金属做正极,不活泼金属或非金属做负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.金属钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)===Cu2++2NO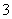 +2NO2↑+2H2O
+2NO2↑+2H2O
C.向Na2SiO3溶液中通入过量CO2:SiO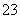 +CO2+H2O===H2SiO3↓+CO
+CO2+H2O===H2SiO3↓+CO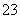
D.将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO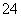 +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com