
| A. | 镁的金属活动性比铷强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性比RbCl弱 | |
| D. | Rb单质比RbCl更稳定 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:实验题
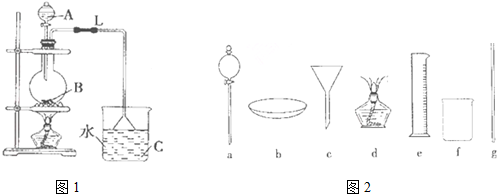
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A.Cl2 >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
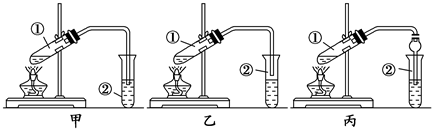
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaHSO4 晶体中含阴阳离子总数是0.3NA | |
| B. | 6.2gNa2O溶入水配成1L溶液,所得溶液的物质的量浓度为0.2 mol/L | |
| C. | 11.2 L CO2和O3混合气体中含有的原子数是1.5 NA | |
| D. | 17 g H2O2完全分解,转移电子数是1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com