
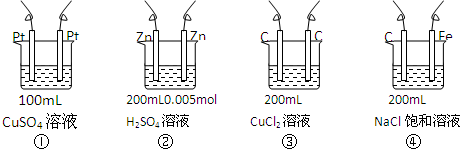
| A. | ①<②<③<④ | B. | ①<③<②<④ | C. | ②<①<④<③ | D. | ①<②<④<③ |
分析 ①中析出铜和氧气,所以电解一段时间后,溶液中酸性增强,②中析出氢气,所以氢离子浓度降低,根据转移电子计算①②中氢离子浓度相对大小,比较酸性强弱,③是电解溶质本身④中阴极上析出氢气,阳极上析出氯气,导致溶液的碱性增强.
解答 解:①总电极反应式:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,阳极电极反应式:2H2O-4e-═4H++O2↑,通过0.002mole-,产生n(H+)=0.002mol,c(H+)=0.02mol•L-1;
②总电极反应式:Zn+2H+$\frac{\underline{\;通电\;}}{\;}$Zn2++H2↑,阴极电极反应式:2H++2e-═=H2↑,通过0.002mole-,消耗H+的物质的量为0.002mol,剩余H+的浓度:c(H$\frac{(200×1{0}^{-3}×0.005×2-0.002)}{(200×1{0}^{-3})mol•{L}^{-1}}$=0,说明H2SO4完全反应,溶质是ZnSO4;
③总电极反应式:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,氯气和水发生极少量的盐酸和次氯酸;
④总电极反应式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,溶液显碱性,
所以c(H+)的从大到小的顺序:①③②④,pH与c(H+)相反,pH由小到大的顺序①<③<②<④;
故选B.
点评 本题考查了电解池原理,明确阴阳极上放电的离子是解本题的关键,难度不大,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
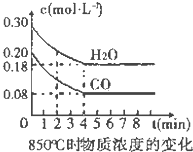 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
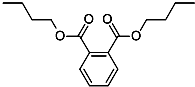 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(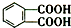 )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 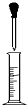 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
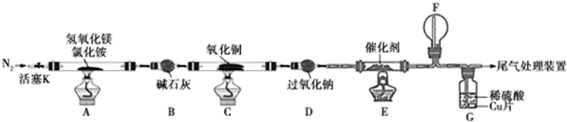
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com