
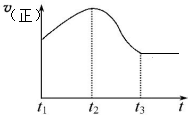
| A. | 元素周期表,一共18个纵行,而元素种类最多的族,在第3纵行 | |
| B. | 无论是吸热反应还是放热反应,升高温度,都能使反应速率加快 | |
| C. | 假设石墨转化为金刚石,需要吸收能量,则说明石墨比金刚石更稳定 | |
| D. | 非金属元素的非金属性越强,其氧化物对应的水化物酸性也一定越强 |
分析 A、由左到右按原顺序编为18纵行.如碱金属为第1纵行,稀有气体为第18纵行,第3列含锕系和镧系以此来解答;
B、温度越高反应速率越快;
C、能量越高越不稳定;
D、最高价氧化物对应水化物.
解答 解:A、由左到右按原顺序编为18纵行.如碱金属为第1纵行,稀有气体为第18纵行,第3列含锕系和镧系,含元素的种类最多,故A正确;
B、温度越高反应速率越快,所以无论是吸热反应还是放热反应,升高温度,都能使反应速率加快,故B正确;
C、假设石墨转化为金刚石,需要吸收能量,说明金刚石能量高,则说明石墨比金刚石更稳定,故C正确;
D、非金属元素的非金属性越强,其最高价氧化物对应的水化物酸性也一定越强,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、周期表的结构为解答的关键,侧重分析与应用能力的考查,注意原子结构与元素的位置,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
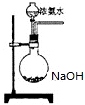 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.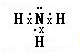 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
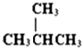 和
和 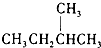 J、
J、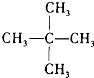 和
和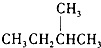
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
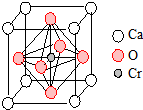 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com