
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

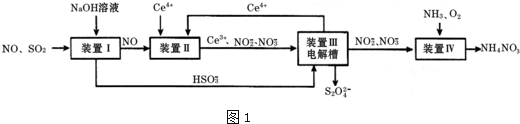
分析 (1)①NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时,由原子守恒可知NaOH与二氧化硫的物质的量比为3:2;
②当混合液中n(SO32-):n(HSO3-)=1:1时,由表格中pH=7.2可知,溶液为碱性,结合电荷守恒分析;
(2)NO被氧化为硝酸根,Ce4+被还原为Ce3+,酸性环境,缺氧补水,缺氢补氢离子完成方程式;
(3)①生成Ce4+为氧化反应,发生在阳极上,连接电源正极,因此从a口流出;
②反应物是HSO3-被还原成S2O42-,得到电子;
(4)NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:1000×(5-3)a/46,设消耗标况下氧气的体积是V,则得电子数目是:V÷22.4×2×(2-0),根据电子守恒进行计算.
解答 解:(1)①NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时,由原子守恒可知NaOH与二氧化硫的物质的量比为3:2,离子反应为2SO2+3OH-=HSO3-+SO32-+H2O,
故答案为:2SO2+3OH-=HSO3-+SO32-+H2O;
②当混合液中n(SO32-):n(HSO3-)=1:1时,由表格中pH=7.2可知,溶液为碱性,c(OH-)>c(H+),由电荷守恒可知,c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),则(Na+)>c(HSO3-)+2c(SO32-),故答案为:>;
(2)NO被氧化为硝酸根,Ce4+被还原为Ce3+,酸性环境,缺氧补水,缺氢补氢离子,所以离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(3)①生成Ce4+为氧化反应,发生在阳极上,连接电源正极,因此从a口流出,故答案为:a;
②反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子为$\frac{1000a×(5-3)}{46}$
mol,设消耗标况下氧气的体积是V,则得电子为$\frac{V}{22.4}$mol×2×(2-0),根据电子守恒可知$\frac{1000a×(5-3)}{46}$=$\frac{V}{22.4}$mol×2×(2-0),解得V=$\frac{5600a}{23}$L,故答案为:$\frac{5600a}{23}$.
点评 本题考查较综合,涉及离子浓度比较、离子反应及电化学、氧化还原反应计算等,注重高频考点的考查,综合考查化学反应原理,把握习题中的信息守恒法应用为解答的关键,注意知识的迁移应用,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题
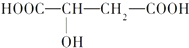
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
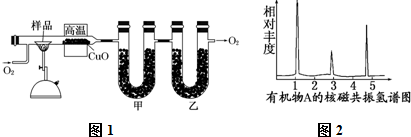
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10℃时pH=12的Na0H溶液与40℃时pH=12的Na0H溶液中:c(OH-)相等 | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)═c(NH4+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | 向10mLpH=12的Na0H溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与SO42-浓度有关 | |
| B. | 催化剂能加快化学反应速率,但反应物所需活化能不变 | |
| C. | 碘单质是过氧化氢分解的催化剂 | |
| D. | 与一定量H2O2反应的KI溶液浓度越大,反应速率越慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com