
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |



科目:高中化学 来源: 题型:
| A、计算机芯片的组成元素位于第14列 |
| B、元素周期表共有7个周期,16个族 |
| C、每一周期的元素都是从碱金属开始,最后以稀有气体结束 |
| D、第二、三周期中,同一列上下相邻元素的原子核外电子数相差8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
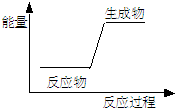
| A、生石灰加水生成熟石灰 |
| B、C+H2O═CO+H2 |
| C、金属钠与水反应 |
| D、HNO3+NaOH═NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
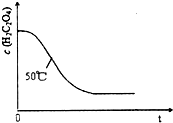
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
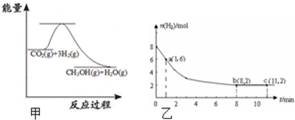 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用一次性木筷,减少疾病传染 |
| B、推广使用电动汽车、天然气汽车等环保公共交通工具 |
| C、大力发展太阳能和风力发电机可缓解电力紧张问题 |
| D、将地沟油回收加工为燃料油,提高资源的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com